Revisado 20/08/2020
Cinética Química
Definição de Cinética Química
Das reações abaixo é reação instantânea apenas:
a) as explosões de fogos de artifício.
a) colisões inertes ou choques defensivos.
b) condições eletivas e choques emocionais.
a) energia cinética e se fixam com energia suficiente para se acomodarem.
Definição de Cinética Química
A cinética química estuda as velocidades das transformações químicas e dos fatores ligados a essas transformações. A cinética procura conhecer as velocidades com que os reagentes são consumidos, na formação dos produtos. Essas velocidades podem ser analisadas, sejam elas nas transformações naturais ou sintéticas, esta última, se enquadra nos conformes da necessidades humanas a que se propõe, por exemplo; há reações em que é interessante para nós que sejam realizadas com maior velocidade, e há reações que é interessante que aconteçam mais lentamente, para obtenção de resultados muito mais satisfatórios.
As Condições Para Acontecer Uma Reação
Para facilitarmos nossa compreensão, podemos observar alguns exemplos práticos de reações químicas mais comuns, entre as centenas ou milhares existentes, que podem ser usadas no entendimento da cinética das transformações.
Reações de Caráter Lento Que se Tornam Rápidas
Podemos citar como exemplo de colisões efetivas, o que acontece na "quebra" do iodeto de hidrogênio gasoso (não é o ácido iodídrico que para se tornar ácido necessita ser misturado com certa quantidade de água) para formação do iodo gasoso e gás hidrogênio.
Energia Luminosa e Fotossíntese
Outro exemplo de transformação que utiliza a energia luminosa é a fotossíntese. Constatamos que os seres vivos clorofilados, utilizam dióxido de carbono e água para sintetizar glicose pela ação da luz. Observemos a reação pela equação:
Equacionando o exemplo sugerido.
Outro exemplo de mudança da concentração dos reagentes e mudança da velocidade da reação e dos produtos sintetizados. Por exemplo a decomposição do etanal em metano e monóxido de carbono.
Catalisador é substância que participa da transformação química acelerando a reação, sem ser consumido pela mesma reação. No final da reação, o catalisador é separado da substância formada e em alguns casos, pode até ser reaproveitado numa próxima. Ao adicionar o catalisador na reação, ocorre a diminuição da energia de ativação.
Exemplos de catalisadores
Ácidos como o ácido sulfúrico (H2SO4), são catalisadores inorgânicos.
Bases como o hidróxido de sódio (NaOH), são catalisadores inorgânicos.
Enzimas como: as lipases, carboxilases, hidrogenases e a gástrica (gastrina), produzidas pelos organismos vivos são catalisadoras.
Na catálise homogênea o catalisador se mistura ao reagente formando um sistema monofásico, no entanto cada substância é distinta na mistura, especialmente o catalisador. Pode-se citar como exemplo, a reação da água oxigenada com uma substância alcalina que libera hidroxila OH- na solução. Na reação o íon, ânion monofásico OH-, que é o catalisador, fica dissolvido na solução, com característica homogênea. A reação pode ser representada pela equação:
A Velocidade Média Das Reações
Observe a reação de combustão da gasolina.
Sabendo que após uma hora e meia de reação foram produzidos 36 mols de CO2. Dessa forma, a velocidade de reação, expressa em número de mols de gasolina consumida por minuto é de:
Calculamos a massa de um mol de gasolina.
Calculamos quantos mols de gasolina foi queimado para gerar a massa de gás carbônico.
Questionário
Velocidade das Reações ou
Tempo de Ocorrência de Reações
Segundo pesquisadores, conforme suas observações, a formação do petróleo leva séculos para se completar.
Os vidros levam 4000 anos para se decomporem.
Certos tipos de plásticos levam até 120 anos para se decomporem.
Um portão de ferro leva de algumas horas a alguns dias, a anos para enferrujar, depende das condições do ambiente em que se encontra.
Uma esponja de aço leva de alguns minutos, em ambiente ácido; vinagre por exemplo, noutro ambiente a oxidação leva algumas horas para acontecer.
Os explosivo são rápidos, a reação acontece em fração de segundo - o trinitrotolueno é um explosivo muito potente, sua velocidade de reação é extremamente rápida.
Os explosivo são rápidos, a reação acontece em fração de segundo - o trinitrotolueno é um explosivo muito potente, sua velocidade de reação é extremamente rápida.
As Condições Para Acontecer Uma Reação
A Afinidade Das Substâncias
Exemplos de Reações Químicas Mais Comuns
Somente substâncias afins reagem uma com a outra. Substâncias que não possuem afinidades não reagem. Em se tratando de moléculas diríamos que as moléculas para se interagirem devem ter, pelo menos uma mínima polaridade entre si.
Exemplos de Reações Químicas Mais Comuns
Reação de formação da amônia
N2(g) + 3 H2(g) → 2 NH3(g) reação lenta - alguns minutos
Reação de combustão do gás butano.
C4H10 (g) + 6 O2(g) + ½ O2(g) → 4 CO2(g) + 5 H2O(g) - rápida -fração de segundo.
Reação de produção da molécula de água por meio de faísca elétrica.
H2(g) + O2(g) ----Faísca → H2O(g) - instantânea - (muito rápida, impossível de se medir)
Reação de produção da molécula de água sem faísca elétrica.
H2(g) + O2(g) → H2O(g) muito lenta - (vários séculos, impossível de se medir)
Reação de dissociação do peróxido de hidrogênio.
2 H2O2(aq) → 2 H2O(l) + O2(g) - Instantânea
Reação do óxido nítrico na formação do trióxido de nitrogênio.
NO2 + NO2 → NO3 + NO - lenta
Reação do trióxido de nitrogênio com monóxido de carbono.
Reação do trióxido de nitrogênio com monóxido de carbono.
NO3 + CO → NO2 + CO2 - rápida ou instantânea
Reação de combustão do gás metano.
CH4(g) + 2 O2(g) → CO2(s) + 2 H2O(g)
- Instantânea
Reação de dissociação do ácido iodídrico em iodo gasoso e gás hidrogênio.
2 HI(g) 500ºC ↔ I2(g) + H2(g) - lenta - mais ou menos 10 minutos o ápice e 40 minutos para o término.
Velocidade Das Reações
Reações Instantâneas
Essas reações tem caráter muito rápido, como exemplo podemos citar a reação da hidrazina (N2H4) com água oxigenada, ou peróxido de hidrogênio (H2O2), é uma reação instantânea, com produção de enorme quantidade de energia, ao serem misturadas, as duas substâncias reagem e se tornam o combustível propelente para foguetes.
As explosões de fogos de artifício são exemplos de reações instantâneas.
A injeção da gasolina no motor do veículo, e a faísca da vela gerando a sua combustão, a explosão no motor com liberação de gases que geram a força mecânica de empuxo, é uma reação muito rápida.
A equação da combustão da gasolina pode ser representada:C8H18 + 12 + ½
O2 → 8 CO2 + 9 H2O
reação Instantânea
O óxido nítrico reagindo entre si, para formar os produtos trióxido de nitrogênio e monóxido de nitrogênio, produz uma reação lenta. No entanto adicionando monóxido de carbono ao trióxido de nitrogênio a reação se torna muito rápida, com a produção final de dióxido de nitrogênio e gás carbônico.
NO2 + NO2 → NO3 + NO - reação lenta
NO3 + CO → NO2 + CO2 - reação rápida
Outro exemplo de mudança da velocidade da reação, é o gás hidrogênio reagindo com o óxido de nitrogênio, que produz o óxido de dinitrogênio e água, a reação é lenta. No entanto, o gás hidrogênio ao reagir com o óxido de dinitrogênio, para formar o gás nitrogênio e água é rápida.
Outro exemplo de mudança da velocidade da reação, é o gás hidrogênio reagindo com o óxido de nitrogênio, que produz o óxido de dinitrogênio e água, a reação é lenta. No entanto, o gás hidrogênio ao reagir com o óxido de dinitrogênio, para formar o gás nitrogênio e água é rápida.
H2(g) + 2 NO(g) → N2O(g) + H2O(l) lenta
H2(g) + N2O(g) → N2(g) + H2O(l) rápida
Reações Não Instantâneas
Há reações que demoram muito tempo para se completarem, ou podem até mesmo serem retardadas. O enferrujamento de um portão de ferro expostos as intempéries, pode ser retardado por muitos anos, protegendo-o com uma camada de tinta zarcão (Pb3O4) que é um protetor anticorrosivo e antioxidante de superfícies ferrosas. O zarcão possui na sua composição uma resina alquídica que é sintetizada a partir de um poliálcool e um ácido associado a um óleo secante, esse composto é muito utilizado nas tintas a óleo que possibilitam essa característica protetora de metais.
Fatores Que Interferem em Uma Reação Química
Colisões Para Acontecimento Das Transformações
Colisões Efetivas
No estado físico liquido e gasoso as moléculas das substâncias estão em contínuo movimento e sofrem "trombadas" ao acaso, portanto para que haja reação é necessário que as partículas das substâncias estejam em contínuos deslocamento. As colisões efetivas são choques efetivos com energia suficiente que quando direcionados corretamente causam rompimento das ligações de átomos das moléculas para a formação de outra molécula diferente da anterior.
Nas colisões efetivas, as condições de ambas as moléculas em questão, são favoráveis para acontecerem, estão em posições, que as moléculas, disparada por energia de ativação, se põe em movimento com energia suficiente para se chocarem uma com a outra, essa "trombada", promove o rompimento das ligações químicas dos átomos das moléculas e consequentemente suas transformações em diferentes moléculas.
HI(g) colisão efetiva H2(g) + I2(g)
O Número de Colisões e Efetividade
O Número de Colisões e Efetividade
Através de cálculos aplicados sobre a cinética química, pesquisadores chegaram a conclusão de que 1 mol de HI(g) que contém 6,02 x 1023 moléculas, necessita de 1031 colisões por segundo, entre as suas moléculas a 500ºC. Por meio de cálculos químicos especialistas, chegaram ao conhecimento, que apenas uma colisão seja efetiva entre 1,7 trilhões de colisões por segundo. As outras colisões são apenas de trocas de energia.
Segundo os autores Tito e Canto, que tratam o assunto relativo ao número de choques efetivos, no
livro Química na Abordagem do Cotidiano, volume 2, segunda edição, estes dão
a entender que, uma substância empregada numa reação, em temperatura, pressão e
volume conhecidos, com os dados, pode-se determinar o número de choques efetivos. Por
exemplo, segundo cálculos experimentais,
fazendo reagir 1 mol de ozônio a 25 ºC e uma atmosfera de pressão, com o
monóxido de nitrogênio, o número de choques
entre as partículas das substâncias envolventes, para
cada uma das moléculas o número deverá ser de 109 vezes,
para que ocorra apenas um choque efetivo.
Podemos representar equação da reação
conforme está abaixo.
O3 + NO → O2 + NO2
Exercício para melhor compreensão
Exercício para melhor compreensão
1) Se considerarmos que cada molécula deverá se chocar 109 vezes para que apenas uma seja efetiva, pergunta-se: em 10 gramas de ozônio (O3) que reage com o monóxido de nitrogênio (NO), quantos choques serão necessários para que todas as moléculas reajam?
Dados: massa O = 16
O = 16 x 3 = 48 u.m.a.
Primeiramente devemos conhecer o número de moléculas de ozônio em dez gramas.
Conhecendo o número de moléculas de ozônio nas dez gramas, calculamos o número de choques necessários para que toda as moléculas reajam.
São necessários 1,25 x 1032 choques, para que todas as moléculas das substâncias reajam.
Colisões Não Efetivas
Na colisão não efetiva, não ocorre reação química, devido situação desfavorável do choque da molécula, ou mesmo a partícula da substância na forma atômica, que ao bater em outra molécula, não consegue romper as ligações químicas e “quebrar " estrutura desta, que mesmo sofrendo esse impacto energético continua intacta.
Energia de Ativação
Energia Mínima de Ativação
Quanto menor a energia de ativação maior a velocidade da reação.
Quanto Maior a Energia de Ativação Menor A Velocidade da Reação
Para determinadas substâncias, quanto maior a energia de ativação, mais lenta será a velocidade da reação, portanto, estará ativando um menor número de partículas que irão se colidir.
Tipos de Energia de Ativação
Energia Luminosa
A luz é um tipo de radiação eletromagnética que pode influenciar uma reação química. Por exemplo, ao expormos diretamente nosso corpo à luz do sol, nossa pele fica queimada, isto significa que as moléculas que compõem as células de nossa pele, sofreram quebras das ligações de seus átomos componentes, pelo efeito da luz incidente sobre ela. Quanto maior a intensidade da luz, maior é a quantidade de quebra das ligações químicas de suas moléculas.
Uso de Frascos de Cor Âmbar Para Armazenamento de substâncias Sensíveis à Luz
O uso de frascos de cor âmbar se faz necessário, no armazenamento de drogas e diversas outras substâncias, porque evita a Incidência direta da luz sobre as mesmas. As substâncias podem ser preservadas, armazenadas nestes frascos que as protegem da luz. A luz age sobre determinadas substâncias e as fazem sofrer transformação. Nesse caso a utilização dos frascos de coloração âmbar, impede a exposição da substância aos raios de luz.
Brometo de prata e Luz
Brometo de prata e Luz
O brometo de prata (AgBr) muito usado em filme fotográfico sobre a ação da luz reage instantaneamente decompondo-se em prata e bromo.
O brometo de prata (AgBr) também reage com amônia concentrada e se decompõe em bromo (Br-) e amoníaco de prata Ag (NH3)2+, que é usado na fabricação de espelhos. Podemos visualizar a reação pela equação:
AgBr(s) + 2NH3 concentrada → Ag (NH3)2+ + Br-
Energia Luminosa e Fotossíntese
12 H2O + 6 CO2 → 6 O2 + 6 H2O + C6H12O6.
Energia Térmica
Temperatura
Diminuindo a temperatura diminui a velocidade da reação. Alimentos como carnes cruas sofrem decomposição mais rapidamente fora da geladeira, que a conservada no ambiente refrigerado.
O aumento da temperatura aumenta a velocidade da reação. Uma panela cozinhando alimento num fogo baixo, demora seu cozimento, quando aumentamos a chama do fogão o alimento fica pronto mais rapidamente.
Energia Exotérmica
Na energia exotérmica, se a diferença de energia entre energia própria dos produtos, for maior que a energia de ativação, haverá a liberação dessa energia excedente para o ambiente.
Energia Endotérmica
Nesse tipo de reação, ocorre a absorção de energia do meio ambiente. Se a diferença entre a energia própria do produto em transformação for menor que a energia de ativação, a reação será endotérmica.
Natureza dos Reagentes
Poderíamos definir a Natureza dos Reagentes, sendo as substâncias com muitas ligações em sua estrutura molecular, a serem quebradas, em contraste com as substâncias com poucas ligações em sua molécula, a serem quebradas na mesma reação.
Como exemplo, podemos citar o gás metano, com 4 ligações, reagindo com o gás oxigênio numa temperatura de 20 ºC, com relação ao ácido clorídrico, reagindo com hidróxido de sódio a 20 ºC. Esta última reação, é muito mais rápida porque possui muito menos ligações a serem rompidas e muitos menos ligações a serem formadas, na síntese do novo produto que a primeira.
Equacionando o exemplo sugerido.
Concentração dos Reagentes e a Velocidade Inicial de Reação
Quanto menor a concentração de reagentes, mais lenta será a velocidade de reação, devido á menor quantidade de choques efetivos.
Quanto maior a concentração de reagentes, maior será a velocidade da reação, devido a maior quantidade de choques efetivos.
Observe as seguintes concentrações, e as velocidades iniciais. Em temperatura constante, ao duplicar a concentração de N2O3, duplica a velocidade da reação, ao triplicar a concentração triplica a velocidade de reação.
2 N2O5 → 4 NO2 + O2
0,010 mol/L de N2O5 → 0,016 mol/L .h
0,020 mol/L de N2O5 → 0,032 mol/L . h
0,030 mol/L de N2O5 → 0,048 mol/L . h
Observação: mol/L . h = mol por litro em uma hora.
(Etanal) CH3COH → CH4 + CO
As três reações abaixo demonstram que, quanto maior a concentração do soluto que reage,
maior será a velocidade inicial da reação.
maior será a velocidade inicial da reação.
CH3COH mol/L = 0,10 → Velocidade inicial = 0,085 mol/L . h
CH3COH mol/L = 0,20 → Velocidade inicial = 0,340 mol/L . h
CH3COH mol/L = 0,30 → Velocidade inicial = 0,765 mol/L . h
Superfície de Contato
Quanto Maior a Superfície de Contato Maior a Velocidade da Reação
Um comprimido sal de fruta inteiro possui menor superfície de contato que um comprimido moído.
Catalisadores
Catalisador é substância que participa da transformação química acelerando a reação, sem ser consumido pela mesma reação. No final da reação, o catalisador é separado da substância formada e em alguns casos, pode até ser reaproveitado numa próxima. Ao adicionar o catalisador na reação, ocorre a diminuição da energia de ativação.
Exemplos de catalisadores
Catalisador de veículos automotores. Esses catalisadores são construídos a base de platina- (Pt) e paládio- (Pd), tendo ainda uma proporção em alumina (Al2O3).
Catalisadores metálicos - cobalto (Co), níquel (Ni), platina (Pl), paládio (Pd).Ácidos como o ácido sulfúrico (H2SO4), são catalisadores inorgânicos.
Bases como o hidróxido de sódio (NaOH), são catalisadores inorgânicos.
Enzimas como: as lipases, carboxilases, hidrogenases e a gástrica (gastrina), produzidas pelos organismos vivos são catalisadoras.
Temos ainda catalisadores como a alumina Al2O3 utilizada industrialmente na fase de desidratação na produção do álcool.
São ainda catalisadores produtos a base de prata (Ag), cobre (Cu), ferro (Fe), níquel (Ni) que estão proporcionam melhores reações de oxidação.
Ação Catalítica
Ação Catalítica Homogênea em Meio Alcalino
2 H2O2(aq) OH-(aq)→reação→ 2H2O(l) + O2(g) + OH-
Autocatálise
A autocatálise, pode ser definida como aumento do próprio produto formado, prestando ajuda no aumento da velocidade da reação.
Há certas reações que se iniciam com a velocidade da reação lenta. Conforme a reação se desenvolve e o produto vai sendo formado, vai aumentado a velocidade da reação. Nesse caso o produto funciona como catalisador.
A equação abaixo, representa um processo de autocatálise, do cobre com ácido nítrico que no final é transformado o NO (óxido nítrico),que serve como catalisador da reação.
3 Cu (s) + 8 HNO3 (aq) → 3 Cu(NO3)2 (aq) + 4 H2O(l) + 2 NO(g)
Enzimas Como Catalisadores
As enzimas geralmente são substâncias orgânicas de constituição proteica, intra e extra celular, estas últimas, presentes nos fluidos corporais. Geralmente são específicas para um certo tecido ou órgão e atuam acelerando a velocidade das reações bioquímicas. Certas enzimas, aceleram a decomposição de substâncias nocivas, do interior da célula de um organismo, para posterior eliminação.
Inibidores Das Velocidades das Reações
Os inibidores das reações são substâncias que interferem na reação química diminuindo a sua velocidade de transformação. Nesse caso a inibição da velocidade de reação acontece devido ao aumento do consumo de energia de ativação dos reagentes a serem transformados.
A importância dos inibidores de transformações, ou das suas velocidades, se dá pelo fato de serem utilizados, como conservantes de produtos perecíveis, que são os alimentícios, ou os produtos de beleza, diversos cosméticos, farmacêuticos, muitos medicamentos e outros tais como as bebidas que necessitam de preservação.
Podemos citar vários inibidores da velocidade das reações no nosso cotidiano.
Uma a febre alta é uma reação que acelera o metabolismo orgânico. Para desacelerar ou inibir este estado clínico, é aplicado o inibidor da febre alta, um analgésico antitérmico que estabiliza a temperatura corporal. Podemos ainda, citar outro exemplo muito comum dentro de nossos lares, uma geladeira é usada para resfriar e retardar a decomposição de alimentos. Indo mais além, quando pintamos um portão de ferro exposto ás intempéries, com zarcão (Pb3O4), revestimos a sua superfície de contato com o ar ou umidade, e o isolamos protegendo-o, para desacelerar a decomposição do ferro metálico em seu produto final, o óxido de ferro. Essa ação é feita, para preservá-lo contra a ferrugem. Certos vinhos de alta qualidade são preparados lentamente, desacelerando a velocidade da fermentação do suco de uva. Aditivos específicos, são adicionados à gasolina, para desacelerar sua detonação e promover um melhor rendimento do motor do veículo.
Decomposição da Água Oxigenada em Meio Ácido
A reação de decomposição da água oxigenada em meio ácido, contendo por exemplo, o cátion H3O+, inibe o desenvolvimento da velocidade da reação, tornando-a lenta.
2 H2O2(aq) → H3O+(aq) → 2 H2O(l) + O2(g)
Benzoato de sódio (C7H5O2Na) Inibidor
Benzoato de sódio (C7H5O2Na), apresentado geralmente na forma de pó branco cristalino, atua como bactericida fungicida e aromatizante, sendo aplicado na indústria alimentícia, é utilizado na proporção de 0,5 a 1,0 grama para cada quilograma do produto em conserva. Tem a sua aplicação industrial na fabricação de margarinas, bebidas que se adicionam o gás carbônico (CO2) que lhe dão efervescência, é adicionado também em saladas de frutas, sucos de frutas, marmeladas, geleias, gelatinas, balas, tortas de fruta, molhos, embutidos e frutos do mar em conservas. Segundo algumas pesquisas em andamento, pode haver perigo como conservante, quando associado com a substância ácido ascórbico, que se interagem e formam o benzeno, que é cancerígeno.
Abaixo é representada a fórmula estrutural plana e molecular do benzoato de sódio.
É de relevante importância saber que, com o advento da radiação ultravioleta como agente esterilizante de produtos em embalagens hermeticamente fechadas, o uso de alguns conservantes vem sendo abandonado.
Abaixo é representada a fórmula estrutural plana e molecular do benzoato de sódio.
É de relevante importância saber que, com o advento da radiação ultravioleta como agente esterilizante de produtos em embalagens hermeticamente fechadas, o uso de alguns conservantes vem sendo abandonado.
A Velocidade Média Das Reações
1) Sabemos que o conteúdo do botijão de gás de cozinha butano (C4H8) pesa 13,5 Kg. Primeiramente transformando 13,5 quilogramas de C4H8 em gramas = 13 500 g.
Após acharmos esse valor, calculamos o número de mol contidos nesse valor.
O botijão de gás contém 241,07 mols do gás.
Sabendo que uma dona de casa utiliza o fogão por três
horas diárias, e o gás dura 45 dias. Qual a velocidade média da queima do gás em
mol por hora?
Resolução.
2) (Mackenzie – SP) adaptado.
Observe a reação de combustão da gasolina.
Calculamos a massa de um mol de gasolina.
Calculamos a massa de gás carbônico produzida com a massa de um mol de gasolina. E a massa em gramas de 36 mols de gás carbônico.
Calculamos a gasolina consumida por minuto em mols:
1) A cinética química estuda:
a) as temperaturas das reações
Físicas.
b) as
temperaturas das reações químicas.
c) a velocidades das reações
químicas.
d) a tonoscopia
de uma solução.
e) a crioscopia
de uma solução.
2) As
condições ideais para acontecer uma reação química:
a) É a solubilidade, somente substâncias
solúveis
reagem
uma com a outra. Substâncias que possuem
solubilidade,
reagem entre
si.
b) É a
acidez, somente substâncias ácidas reagem uma com a outra. Substâncias que não
possuem acidez não reagem entre si.
c) É a concentração, somente
substâncias concentradas reagem uma com a outra. Substâncias não concentradas
não reagem entre si.
d) É a
afinidade, somente substâncias afins reagem uma com a outra. Substâncias que
não são afins não reagem entre si.
e) É a apolaridade,
somente substâncias polares reagem uma com a outra. Substâncias não polares não
reagem entre si.
3) A hidrazina
(N2H4) com água oxigenada, ou peróxido de hidrogênio (H2O2) é uma reação,
que produz enorme
quantidade de energia, essa mistura se torna propelente para foguetes.
Sobre a velocidade dessa reação podemos dizer que é uma reação:
a) lenta.
b) incompleta.
c) que absorve energia.
d) de velocidade intermediária.
e) instantânea.
4) Sobre reações Reações Instantâneas, podemos afirmar que essas reações tem caráter muito rápido, como exemplo podemos citar a reação da hidrazina (N2H4) com água oxigenada, ou peróxido de hidrogênio (H2O2), é uma reação instantânea, com produção de enorme quantidade de energia, ao serem misturadas, as duas substâncias reagem e se tornam o combustível propelente para foguetes.
Das reações abaixo é reação instantânea apenas:
a) as explosões de fogos de artifício.
b) o enferrujamento de um portão de ferro.
c) certos plásticos levam até 120 anos para decomporem.
d) uma plantinha crescendo.
e) o endurecimento do concreto armado.
5) No estado físico liquido e gasoso as moléculas das substâncias estão em contínuo movimento e sofrem "trombadas" ao acaso, portanto para que haja reação é necessário que as moléculas das substâncias estejam em contínuos deslocamentos, que quando direcionados corretamente causam um fenômeno com energia suficiente para romper átomos, e posteriormente leva a formação de outra molécula diferente da anterior.
Esse fenômeno é chamado de:
a) colisões inertes ou choques defensivos.
b) condições eletivas e choques emocionais.
c) colisões inapropriadas ou choques elétricos.
d) colisões efetivas ou choques efetivos.
e) coerção efetivas ou toques efetivos.
6) Nas colisões efetivas, as condições de ambas as moléculas em questão, são favoráveis para acontecerem, estão em posições, para que essas partículas, disparadas causam "trombadas" e promove o rompimento das ligações químicas dos átomos das moléculas e. consequentemente suas transformações.
Complete o sentido do parágrafo acima: a partir da palavra... disparada por:
a) energia cinética e se fixam com energia suficiente para se acomodarem.
b) entropia suficiente e se estabilizam com energia suficiente para duplicarem.
c) energia de ativação e se movimentam com energia suficiente para se chocarem.
d) energia de ativação e se movimentam com pouca energia, o suficiente para se chocarem.
e) energia térmica rompem com velocidade suficiente para se desfazerem.
7) Devido situação desfavorável do choque da molécula, ou mesmo a partícula da substância na forma atômica, que ao bater em outra molécula, não consegue romper as ligações químicas e “quebrar " estrutura desta, que mesmo sofrendo esse impacto energético continua intacta.
Assinale apenas a alternativa correta. Não ocorre reação química:
a) quando a substância está congelada.
b) quanto a energia aplicada é tão forte que desacelera a reação.
c) na aproximação entre as moléculas.
d) na colisão não efetiva.
e) nas reações endotérmicas.
8) Acontece na energia de ativação:
a) quanto menor a energia de ativação maior a velocidade da reação.
b) quanto maior a energia de ativação maior a velocidade da reação.
c) não há necessidade de se aplicar energia de ativação, as reações acontecem aleatórias.
d) a energia de ativação só e necessária quando ocorre parada da reação.
e) há muita necessidade de energia elétrica nas reações.
9) Ocorre no armazenamento de drogas e diversas outras substâncias em frascos âmbar. A luz age sobre determinadas substâncias e as fazem sofrer transformação. Nesse caso a utilização dos frascos de coloração âmbar, impede a exposição da substância aos raios de luz. Porque:
a) proporciona a Incidência direta da luz sobre elas e podem ser preservadas de reagirem.
b) evita a Incidência direta da luz sobre elas que reagem espontaneamente.
c) evita a Incidência direta da luz sobre elas e podem ser preservadas de reagirem.
d) evita a Incidência direta da energia térmica sobre elas para não reagirem.
e) facilita a Incidência direta da luz sobre elas e podem ser preservadas de reagirem.
10) Com relação a concentração dos reagentes e a velocidade inicial da reação é correto afirmar que: quanto maior sua concentração:
a) menor será a velocidade da reação, devido a menor quantidade de choques elétricos.
b) maior será a velocidade da reação, devido a maior quantidade de choques efetivos.
c) não ocorre reação, devido a maior quantidade de reagentes.
d) maior será a velocidade da reação, que aumenta até acabar o reagente.
e) não há velocidade da reação, enquanto houver choques efetivos.
11) De acordo com tipos de energia de ativação da transformação, constatamos que os seres vivos clorofilados, utilizam dióxido de carbono e água para sintetizar glicose pela ação da luz conforme a reação.
12 H2O + 6 CO2 → 6 O2 + 6 H2O + C6H12O6.
Esse tipo de energia utilizada é:
a) elétrica, ou eletricidade.
b) térmica, ou calor.
c) eólica, ou dos ventos.
d) mecânica, ou energia dos corpos.
e) luminosa, a fotossíntese.
12) Observe as seguintes concentrações, e as velocidades iniciais em temperatura constante. É dada a concentração dos reagentes e a velocidade inicial de reação.
CH3COH mol/L = 0,10 → Velocidade inicial = 0,085 mol/L . h
CH3COH mol/L = 0,20 → Velocidade inicial = 0,340 mol/L . h
CH3COH mol/L = 0,30 → Velocidade inicial = 0,765 mol/L . h
As reações três reações demonstram que, quanto:
a) menor a concentração do soluto que reage, menor será a velocidade final da reação.
b) maior a concentração do soluto que reage, maior será a velocidade inicial da reação.
c) maior a quantidade do solvente que reage, maior será a incapacidade final da reação.
d) menor a concentração do soluto que reage, pior será a atividade inicial da reação.
e) maior a temperatura do solvente que reage, menor será a velocidade total da reação.
13) Com relação á superfície de contato podemos afirmar que:
a) quanto menor o interior para contato maior o tempo da reação.
b) a superfície de contato nada tem a ver com a velocidade da reação.
c) sem a superfície de contato a reação se torna mais rápida.
d) quanto maior a superfície de contato maior a velocidade da reação.
e) a superfície atrasa a velocidade da reação o que é bom.
14) Catalisador é substância que participa da transformação química:
a) desacelerando a reação,sendo consumido pela mesma reação.
b) desacelerando a reação, sendo consumido pela reação que fica mais forte.
c) acelerando a reação, sem ser consumido pela mesma reação.
d) acelerando a reação, sendo integrado pela mesma reação formando o composto.
e) inibindo a reação, sem ser consumido pela mesma reação.
15) No final da reação, o catalisador é separado da substância formada e em alguns casos, pode até ser reaproveitado numa próxima. Ao adicionar o catalisador na reação, ocorre:
a) o aumento da energia de ativação.
b) a parada da energia de ativação que se estagna.
c) ocorre a diminuição da energia de ativação e posterior parada da reação.
d) ocorre o aumento da energia de ativação, consumindo mais.
e) ocorre a diminuição da energia de ativação.
16) Com relação a velocidade
média das reações, sabemos que o conteúdo do botijão de gás de cozinha butano (C4H8) pesa
13,5 Kg. Transforme esse peso em gramas, depois calcule o número de mol, e sabendo que uma dona de casa utiliza o fogão por três horas diárias, e o botijão de gás dura 45 dias. Qual a velocidade média da queima do gás em mol por hora?
Responda fazendo o cálculo.
17) O benzoato de sódio atua como bactericida fungicida e aromatizante,, portanto, é adicionado em alimentos como: refrigerantes, sucos, temperos, vinhos, ketchups, margarinas, geleias, cidras, no tempero de saladas, na cafeína em embutidos como piclesm cogumelos em cosméticos tipo cremes e loções. O benzoato de sódio também é usado em soluções farmacêuticas na agricultura e em alimentos de animais. Nesse caso, o benzoado de sódio é um:
a) acelerador da velocidade das reações químicas.
b) inibidor das reações fotossensíveis.
c) promovedor das reações químicas.
d) inibidor da velocidade das reações químicas.
e) acelerador da deterioração de objetos que oxidam.
Bibliografia.
Lia Monguilhott Bezerra, Julio Cezar Foschini Lisboa, Aline Tahis Bruni. Ana Luiza Petilo Nery, Paulo A.G. Bianco, Rodrigo Marchiori Liegel, Simone Garcia de Ávila, Simone Jaconetti Ydi, Solange Wagner Locatelli, Vera Lucia Mitiko Aoki. Ser Protagonista Química 2, Ensino Médio Química 2º Ano, Manual do Professor 3ª edição SM Ltda, São Paulo 2016.
Martha Reis. Coleção Química Ensino Médio, Volume 2, Química Meio Ambiente Cidadania Tecnologia. Editora FTD 1ª Edição São Paulo 2010.
Francisco Miragaia Peruzzo, Eduardo Leite do Canto. Química na Abordagem do Cotidiano, Físico Química Volume 2 2ª Edição Editora Moderna. São Paulo 1999.
Ricardo Feltre. Química, Físico - Química Volume 2, 6ª Edição, Editora Moderna São Paulo 2004.João Usberco Edgard Salvador. Química - Físico - Química 2, Editora Saraiva 1ª Edição São Paulo 1995.
Geraldo Jose Covre. Química - O Homem e a Natureza, Físico - Química 2, Editora FTD, São Paulo 2000.
João Usberco, Edgard Salvador. Química, volume Único. Editora Saraiva, 5ª Edição, 2ª Tiragem São Paulo 2003.
pt.wikipedia.org > wiki > Cinética_quimica
Cinética química - Wikipédia, a enciclopédia livre
Wildson Luiz Pereira Dos Santos, Gerson de Souza Mól, Roseli Takako Matsunaga, Siland Meiry França Dib, Eliane Nilvana F. de Castro, Gentil de Souza Silva, Sandra Maria de Oliveira Santos, Salvia Barbosa Farias. Química & Sociedade, Pequis Projeto de Ensino de Química e Sociedade. Volume único 1ª Edição Editora Nova Geração São Paulo 2008
pt.khanacademy.org > chem - kinetics > types -of-catalysts
Tipos de catalisadores (artigo) | Cinética | Khan Academy
Geraldo
Camargo de Carvalho. Química Moderna 2 Fisicoquímica - Química Inorgânica
Descritiva. Editora Scipione, 2ª Edição 1995.




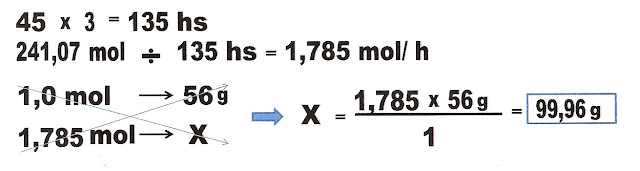


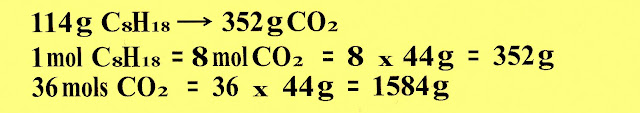



Nenhum comentário:
Postar um comentário