Ligações Covalentes Dativas
Ligação Covalente Dativa ou Coordenada
O Que é Ligação Covalente Dativa?
Simplificando a resposta, podemos dizer que ligação covalente dativa é o tipo de ligação em que um dos elementos químicos participantes da molécula em formação, empresta ou compartilha um par de elétrons com o outro que é instável e se aproxima da partícula já semi-formada por ligações covalentes normais.
O par de elétrons é deslocado do átomo da molécula em formação para o outro para a composição do octeto, ambos compartilham desse par no preenchimento de todos os orbitais semi preenchidos, ou seja; com oito elétrons na camada mais energética. Nesse caso, por exemplo; o elemento químico deve pertencer à aqueles que se incluem na regra do octeto.
As famílias dos elementos químicos que formam ou não ligações covalentes dativas
Os elementos químicos da família 1A da tabela periódica pode formar uma ligação covalente molecular normal mas nenhuma ligação covalente dativa.
Os elementos químicos da família 4 A da tabela periódica pode formar quatro ligações covalentes normais mas nenhuma ligação covalente dativa.
Os elementos químicos da família 5 A da tabela periódica pode formar três ligações covalentes normais e apenas uma ligação ligação covalente dativa.
Os elementos químicos da família 6 A da tabela periódica pode formar duas ligações covalentes normais e até duas ligações covalentes dativas.
Os elementos químicos da família 7 A da tabela periódica pode formar uma ligação covalente normal e até três ligações covalentes dativas.
Usando sinais representativos (válidos apenas para ilustração do texto)
Estrelinha significa o elétron.
Seta indicando a direção que o par de elétrons é deslocado.
Duas estrelinhas significa o par de elétrons da ligação covalente dativa.
A Formação Das Moléculas Com Ligação (ões) Covalente (s) Dativa (s)
Começaremos pela distribuição dos elétrons do átomo de oxigênio que possui seis elétrons na ultima camada e combinam entre si para formarem o octeto (oito elétrons).
A molécula formada apresenta ligação covalente normal dupla e uma ligação covalente dativa, que está representada pela flecha apontada para o sentido em que o par de elétrons é deslocado.
A formação da molécula de dióxido de enxofre ou gás sulfuroso
A distribuição eletrônica do átomo de enxofre.
A distribuição eletrônica do átomo de oxigênio.
Conhecendo o número de elétrons da camada de valência de cada átomo já posso efetuar as ligações covalentes normais e covalentes dativa entre esses elementos químicos para a formação da molécula.
Da mesma forma que a anterior, a molécula formada apresenta ligação covalente normal dupla e uma ligação covalente dativa que está representada pela flecha apontada para o sentido em que o par de elétrons é deslocado.
A formação do anidrido sulfúrico ou gás sulfúrico (SO3) – trióxido de enxofre ou ainda óxido de enxofre.
Na formação do trióxido de enxofre há uma ligação covalente normal dupla e o restante dos elétrons se rearranjam formando duas ligações covalentes dativas.
A formação do monóxido de carbono (CO)
A molécula do monóxido de carbono é formada por uma única tripla ligação, dois pares de elétrons formam a dupla ligação covalente molecular normal e um par de elétrons forma a ligação covalente dativa.
Ácido Nítrico
Ácido Nítrico
A formação da molécula do ácido nítrico.
O ácido nítrico possui duas ligações covalentes normais simples, uma ligação covalente normal dupla e uma ligação covalente dativa.
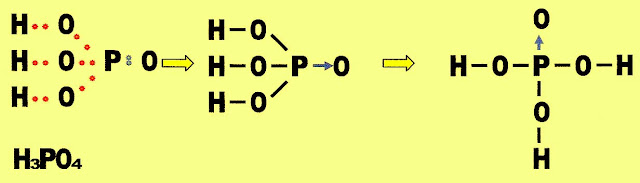
Ácido Fosfórico
Ácido Fosfórico
A formação da molécula do ácido fosfórico.
A molécula do ácido fosfórico é formada por seis ligações covalentes moleculares normais simples e uma ligação covalente dativa.
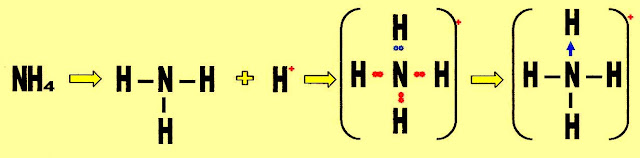
Montagem da fórmula estrutural do íon amônio (NH4)
O íon amônio possui três ligações covalentes moleculares normais e uma ligação covalente dativa.
Pentóxido de Dicloro
As quatro estruturas abaixo são as fórmulas: da esquerda para direita, molecular condensada, fórmula eletrônica, estrutural plana e novamente estrutural plana, do pentóxido de dicloro. (Cl2O5). Dichlorine Pentoxide.
Pentóxido de Dinitrogênio
As três estruturas abaixo são as fórmulas: molecular condensada, fórmula eletrônica e fórmula estrutural plana do pentóxido de dinitrogênio (N2O5)
Pentóxido de Dicloro
As quatro estruturas abaixo são as fórmulas: da esquerda para direita, molecular condensada, fórmula eletrônica, estrutural plana e novamente estrutural plana, do pentóxido de dicloro. (Cl2O5). Dichlorine Pentoxide.
O pentóxido de dicloro apresenta 4 ligações covalentes dativas e 2 ligações covalentes moleculares normais.
Pentóxido de Dinitrogênio
As três estruturas abaixo são as fórmulas: molecular condensada, fórmula eletrônica e fórmula estrutural plana do pentóxido de dinitrogênio (N2O5)
A molécula do pentóxido de dinitrogênio é formado por duas ligações covalentes moleculares simples duas ligações covalentes dupla e duas ligações covalentes dativas.
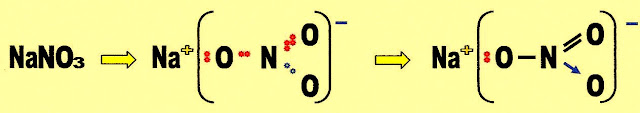
Nitrato de Sódio
As três estruturas abaixo são as fórmulas: molecular condensada, fórmula eletrônica e fórmula estrutural plana, do composto iônico nitrato de sódio (NaNO3
O nitrato de sódio é formado por uma ligação iônica, uma ligação covalente molecular simples, uma ligação covalente molecular dupla e uma ligação covalente dativa.
Ácido Sulfúrico
As três estruturas abaixo são as fórmulas: molecular condensada, fórmula eletrônica e fórmula estrutural plana da molécula do ácido sulfúrico.
A molécula do ácido sulfúrico possui quatro ligações covalentes normais e duas ligações covalentes dativas.
Pentóxido de Dicloro
As três estruturas abaixo são as fórmulas: molecular condensada, fórmula eletrônica, e fórmula estrutural plana da molécula do pentóxido de dicloro (Cl2O5).
Pentóxido de Dicloro
As três estruturas abaixo são as fórmulas: molecular condensada, fórmula eletrônica, e fórmula estrutural plana da molécula do pentóxido de dicloro (Cl2O5).
A molécula do pentóxido de dicloro possui duas ligações covalentes normais e quatro ligações covalentes dativas.
Ácido Perclórico
As três estruturas abaixo são as fórmulas molecular condensada, eletrônica e estrutural plana da molécula do ácido perclórico.
Ácido Perclórico
As três estruturas abaixo são as fórmulas molecular condensada, eletrônica e estrutural plana da molécula do ácido perclórico.
A molécula do ácido perclórico possui duas ligações covalentes moleculares normais e três ligações covalentes dativas.
As quatro estruturas abaixo são as fórmulas: da esquerda para direita, molecular condensada, fórmula eletrônica, estrutural plana e novamente estrutural plana, do ácido clórico.
Exercícios
2) De acordo com as ligações covalentes dativa, a fórmula correta do dióxido de enxofre é:
a) ( ) b) ( ) c) ( ) d) ( ) e) ( )
5) Observe a molécula abaixo.
Conforme os conceitos da ligação covalente dativa, a fórmula eletrônica correta com os pares de elétrons formando as ligações entre os átomos do ácido nítrico (HNO3) é:
a) ( ) b) ( ) c) ( ) d) ( ) e) ( )
Ácido Clórico
As quatro estruturas abaixo são as fórmulas: da esquerda para direita, molecular condensada, fórmula eletrônica, estrutural plana e novamente estrutural plana, do ácido clórico.
A molécula do ácido clórico é formada por uma única ligação covalente molecular normal e três ligações covalentes dativas.
Heptóxido de Dicloro
As três estruturas abaixo representam a fórmula molecular condensada, eletrônica e fórmula estrutural plana da molécula do heptóxido de dicloro.
O heptóxido de dicloro ou anidrido perclórico, apresenta na sua estrutura molecular 6 ligações covalentes dativas e duas ligações covalentes moleculares normal.
Heptóxido de Dicloro
As três estruturas abaixo representam a fórmula molecular condensada, eletrônica e fórmula estrutural plana da molécula do heptóxido de dicloro.
O heptóxido de dicloro ou anidrido perclórico, apresenta na sua estrutura molecular 6 ligações covalentes dativas e duas ligações covalentes moleculares normal.
1) Qual é a família dos elementos químicos que formam três ligações covalentes moleculares normais e apenas uma ligação covalente dativa.
a) Os elementos químicos da família 4 A da tabela periódica podem formar três ligações covalentes normais e apenas uma ligação ligação covalente dativa.
b) Os elementos químicos da família 5 A da tabela periódica podem formar três ligações covalentes normais e apenas uma ligação ligação covalente dativa.
c) Os elementos químicos da família 1 A da tabela periódica podem formar três ligações covalentes normais e apenas uma ligação ligação covalente dativa.
d) Os elementos químicos da família 7 A da tabela periódica pode formar três ligações covalentes normais e apenas uma ligação ligação covalente dativa.
e) Os elementos químicos da família 6 A da tabela periódica pode formar três ligações covalentes normais e apenas uma ligação ligação covalente dativa.
4) Na ligação covalente dativa, a fórmula correta do ácido clórico (HClO3) é:
a) ( ) b) ( ) c) ( ) d) ( ) e) ( )
5) Observe a molécula abaixo.
Conforme os conceitos da ligação covalente dativa, a fórmula eletrônica correta com os pares de elétrons formando as ligações entre os átomos do ácido nítrico (HNO3) é:
a) ( ) b) ( ) c) ( ) d) ( ) e) ( )




















Professor, o pentóxido de dinitrogênio é formado por duas ligações duplas, e não como foi apresentado.
ResponderExcluirHclo
ResponderExcluirPerfeito!! Muito obrigada
ResponderExcluir