Ligações Covalentes
Ligações Covalentes Moleculares Normais
As ligações covalentes moleculares acontecem entre átomos de elementos químicos semi metálicos e não metálicos. É o tipo de ligação em que o par de elétrons é compartilhado por dois átomos. Esse par de elétrons, ou pares de elétrons, é (são) formado (s) por elétrons de cada um dos átomos participantes.
As Formas Dos Orbitais e as Ligações “s” e “p”.
Ligações Covalentes Moleculares Normais
As ligações covalentes moleculares acontecem entre átomos de elementos químicos semi metálicos e não metálicos. É o tipo de ligação em que o par de elétrons é compartilhado por dois átomos. Esse par de elétrons, ou pares de elétrons, é (são) formado (s) por elétrons de cada um dos átomos participantes.
As Formas Dos Orbitais e as Ligações “s” e “p”.
A Forma do Orbital "s"
Todos os orbitais do sub-nível “s” possuem a forma circular.
Todos os orbitais do sub-nível “s” possuem a forma circular.
A substância simples formada por hidrogênios o gás hidrogênio, conforme a distribuição eletrônica, só possui o orbital “s”, a ligação formada é do tipo sigma (σ) ou s - s.
As Formas Dos Orbitais “p”. P1, p2, p3
O orbital p é formado pelo (s) eletron (s) que está (ão) no (s) subnível (eis) p. O orbital p é alongado em forma de hélice ou bilobulado direcionado para um um eixo central, o núcleo do átomo.
A figura abaixo representa os orbitais do subnível 1S, 2S, e 3S e o subnível p com os orbitais p1, p2 e p3.
O orbital p é formado pelo (s) eletron (s) que está (ão) no (s) subnível (eis) p. O orbital p é alongado em forma de hélice ou bilobulado direcionado para um um eixo central, o núcleo do átomo.
A figura abaixo representa os orbitais do subnível 1S, 2S, e 3S e o subnível p com os orbitais p1, p2 e p3.
A Hibridação s e p Dos Orbitais
Hibridação pode ser definida como a rearrumação dos níveis de energia ou dos orbitais, de um átomo para que ele possa se unir a outro átomo. Os orbitais s e p puros podem sofrer "fusão" e se transformarem em orbital (is) sp.
O orbital s que é circular se alonga e o orbital p que é longo encurta, tomando a aparência sugerida na figura abaixo.
Vejamos o passo a passo da hibridação.
O elemento químico boro no estado fundamental se apresenta conforme o esquema:
Podemos observar esse acontecimento através da distribuição eletrônica do elemento químico cloro, na formação da molécula do gás cloro em que na última camada, ou no último orbital cada átomo possui apenas um elétron. Nesse caso acontece a junção desse orbital semipreenchido com o orbital do outro átomo, também semipreenchido, que formará a ligação sigma pura p, p na molécula. Nesse caso não há a necessidade de hibridização do (s) orbital (is).
Os Elementos Químicos da Tabela Periódica Que Formam as Ligações Covalentes Moleculares NormaisHibridação pode ser definida como a rearrumação dos níveis de energia ou dos orbitais, de um átomo para que ele possa se unir a outro átomo. Os orbitais s e p puros podem sofrer "fusão" e se transformarem em orbital (is) sp.
O orbital s que é circular se alonga e o orbital p que é longo encurta, tomando a aparência sugerida na figura abaixo.
A Hibridação do Berílio
A hibridação do berílio para a ligação com o hidrogênio (aqui o berílio não está presente na relação da tabela periódica apresentada mais abaixo, como átomo que faz parte nas ligações covalentes moleculares).
Primeiramente fazermos a distribuição eletrônica para sabermos como os seus elétrons estão posicionados nos orbitais.
Observando a distribuição eletrônica do átomo de berílio percebemos que os elétrons estão parelhados em seus orbitais preenchendo-os totalmente. Nesse caso não há como o berílio se ligar a outro átomo para formar outra substância sem que haja mudança estrutural, é necessário haver transformações na sua estrutura atômica para que possa formar novos orbitais e se ligar a outro átomo. Portanto ocorre a hibridação ou seja a formação de novos orbitais.
Finalmente os hidrogênios se aproximam e se ligam ao berílio.
Hibridação do Boro
Vejamos o passo a passo da hibridação.
O elemento químico boro no estado fundamental se apresenta conforme o esquema:
Inicialmente o boro passa por um processo de ativação. Ao ser ativado ocorre o deslocamento de um elétron do subnivel s para o subnivel p, portanto, esse nível passa a ter dois orbitais p, o p1 e o p2.
Ao ser hibridizado a molécula do boro passa a ter a configuração com orbitais sp da seguinte forma: O orbital 2s se alonga e forma o sp, os dois orbitais p formados “encolhem” sua órbita e se transformam em sp. Desse modo a estrutura formada passa a ter três orbitais sp. Sp1 sp2 e sp3 semipreenchidos com apenas um elétron cada e um orbital s completamente preenchido com 2 elétrons conforme mostra o esquema:
Convém também salientar a disposição geométrica de cada um dos orbitais híbridos da molécula formada possui ângulos de 120 graus.
A Hibridação Sp3 do Carbono
O átomo de carbono pode se hibridizar formando o tipo de hibridação sp3. Vejamos passo a passo essa configuração atômica. Essa hibridação forma ligações covalentes moleculares normais.
A última camada do átomo de carbono possui 4 elétrons distribuídos em dois subniveis o s preenchido e o p, este último semipreenchido com um elétron cada e um orbital completamente vazio. Um elétron do orbital ou subnivel s passa para o orbital ou subnivel p formando o orbital p3 semipreenchido.
Finalmente ocorre a transformação do orbital s que ficou semipreenchido com apenas um elétron que sendo circular se alonga se transformando em sp. Os três orbitais p, longos semipreenchidos com um elétron cada se retraem adquirindo a conformação sp. Ao todo são formados 4 orbitais sp com um elétron cada.
Quando as ligações covalentes forem do tipo simples ou sigma.
Podemos observar esse acontecimento através da distribuição eletrônica do elemento químico cloro, na formação da molécula do gás cloro em que na última camada, ou no último orbital cada átomo possui apenas um elétron. Nesse caso acontece a junção desse orbital semipreenchido com o orbital do outro átomo, também semipreenchido, que formará a ligação sigma pura p, p na molécula. Nesse caso não há a necessidade de hibridização do (s) orbital (is).
Ligação Covalente Molecular Normal - A Formação de Substâncias Simples
Representação Esquemática (não é válida didaticamente).
Estrelinha - representa um elétron.
Par de estrelinhas - representa o par de elétrons compartilhado.
Traço - representa a ligação covalente molecular normal.
Gás hidrogênio
A formação do gás hidrogênio.
O gás hidrogênio é um combustível muito potente não poluente, a sua combustão seja em veículos automotores, ou em outra forma de produção de energia, não liberará substâncias nocivas à saúde humana.
Gás flúor
A formação do gás flúor.
Flúor ligação covalente molecular
Gás cloro
A formação do gás cloro.
Gás cloro
A formação do gás cloro.
Iodo ligação covalente molecular normal
Gás oxigênio
A formação da substância gás oxigênio.
Gás nitrogênio
A formação da substância gás nitrogênio.
Formação de Substâncias Compostas Com Ligação Covalente Molecular Simples, Duplas e triplas
Obtenção e Uso
O ácido cianídrico é extremamente volátil e se encontra na mandioca, nas sementes de maçã, pêssego e cerejas.
É utilizado na fabricação de alguns tipos de plástico como o acrilonitrilo e de fibras acrílicas, de corantes e pigmentos para tingir tecidos e também é empregado na produção de pesticidas, nos processos de eletrólise em metais e no tratamento do aço. Por ser altamente tóxico e letal, foi utilizada nas câmaras de gás nos Estados Unidos. Pode ser utilizado como gás de guerra.
Triodeto de fósforo
Formol
Trióxido de difosforo
Ácido clorídrico
A formação do ácido clorídrico.
Água
A formação da molécula de água.
6) Observe bem no esquema abaixo, as formas circulares representando orbitais dos elétrons dos átomos nas ligações covalentes moleculares.
Ácido cianídrico
Obtenção e Uso
O ácido cianídrico é extremamente volátil e se encontra na mandioca, nas sementes de maçã, pêssego e cerejas.
É utilizado na fabricação de alguns tipos de plástico como o acrilonitrilo e de fibras acrílicas, de corantes e pigmentos para tingir tecidos e também é empregado na produção de pesticidas, nos processos de eletrólise em metais e no tratamento do aço. Por ser altamente tóxico e letal, foi utilizada nas câmaras de gás nos Estados Unidos. Pode ser utilizado como gás de guerra.
Triodeto de fósforo
Uso do triodeto de fósforo
O triodeto de fósforo é um sólido vermelho que reage com água. É utilizado como solvente. Também é utilizado na transformação de álcoois em iodeto de alquilas, ou ainda nas reações dos compostos tioacetais e ortotioésteres.
Trióxido de difosforo
O trióxido de difosforo pode ser utilizado para sintetizar ácido clorídrico e ácido fosfórico.
Ácido clorídrico
A formação do ácido clorídrico.
Água oxigenada
A formação da água oxigenada.
Gás carbônico
A formação da molécula de gás carbônico. Essa molécula é apolar, portanto as ligações intermoleculares entre as moléculas do gás carbônico é do tipo dipolo instantâneo-dipolo induzido.
O gás carbônico ou anidrido carbônico, pode ser comprimido em tubos de extintores de incêndio e se torna líquido na temperatura de -56 ºC, é bastante solúvel em água, aproximadamente 1,7 g/L. Sua densidade no estado líquido é de 0,77 g/cm3. O gás carbônico líquido em contato com o ar atmosférico forma gelo seco.
É utilizado em extintores de incêndio,em bebidas como; refrigerantes, cervejas, em produtos alimentares no caso do fermento para pão, como gelo seco é utilizado para refrigerar sorvetes e carnes, serve na preparação do bicarbonato de sódio.
Trióxido de dinitrogênio
A formação da molécula do trióxido de dinitrogênio.
Água
A formação da molécula de água.
Amônia
A formação da molécula de amônia.
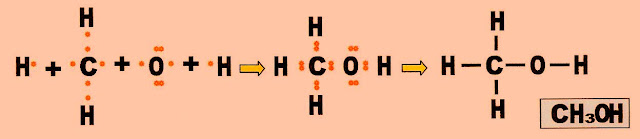
Metanol
A formação da molécula do metanol.
Gás etileno
A formação da molécula do gás eteno ou etileno. Abaixo é apresentada três fórmulas simplificadas desse gás, a fórmula molecular condensada, eletrônica e estrutural plana.
O gás etileno cuja obtenção é por destilação do petróleo, do xisto, ou por vias de sintese química diferentes, apresenta na sua estrutura molecular 4 ligações covalentes simples e uma ligação covalente dupla.
Ácido carbônico
A formação da molécula do ácido carbônico
Cafeína
A molécula da cafeína alcalóide do grupo das xantinas, está presente no café, guaraná, cacau, chá. Pode ser representada com as suas ligações covalentes moleculares simples e duplas.
Paracetamol (C8H9NO2)
A molécula do paracetamol apresenta ligações covalentes moleculares simples e ligações covalentes moleculares duplas.
As duas estruturas logo acima apresentam as fórmulas eletrônicas e estrutural plana da molécula do paracetamol.
Questões
1) As ligações covalentes moleculares acontecem entre átomos de elementos químicos:
a) metálicos e não metálicos.
b) semi metálicos e não metálicos.
c) semi metálicos e gasosos.
d) semi metálicos.
a) não metálicos.
2) Nas ligações covalentes moleculares, o par de elétrons, ou pares de elétrons participantes:
a) são formados apenas por um dos átomos.
b) são transformados por dois átomos átomos.
c) é ou são formado (s) por elétrons de cada um dos átomos.
d) são formados por dois pares de elétrons de cada um dos átomos.
e) são doados por um dos átomos.
3) A molécula do gás ozônio possui uma
dupla ligação covalente molecular e uma ligação covalente dativa entres os
átomos de oxigênio da molécula. Em qual das alternativas estão corretamente
colocadas as ligações covalentes normais e covalente dativa nos átomos de
oxigênio da estrutura do gás ozônio abaixo.
4)
O ácido cianídrico é relativamente fraco, bastante volátil e ioniza facilmente formando cianetos como cianeto de potássio, cianeto de sódio, altamente venenosos. Em sua fórmula estrutural plana, apresenta 4 ligações
covalentes moleculares. O modelo mais correto de representá-lo é:
5) O trióxido de difosforo (oxido de fosforo II) anidrido fosforoso, é um sólido cristalino de cor branca, tóxico e corrosivo sendo utilizado para sintetizar outros compostos químicos. Assinale a alternativa na qual a sua fórmula estrutural plana está representada corretamente.
Essas formas circulares com 2 círculos entrecruzando entre si representam a ligação:
a) iônica entre dois átomos.
b) metálica entre dois átomos.
c) intermolecular entre dois átomos.
d) covalente molecular simples entre dois átomos.
e) covalente dativa tripla entre dois átomos.
7) Observe na figura abaixo o modelo de ligação covalente molecular entre dois átomos de oxigênio para formar a molécula do gás oxigênio gás muito importante para a vida dos seres vivos.
Essa ligação é covalente molecular:
a) simples porque tem apenas um traço representativo da ligação entre os dois átomos.
b) dupla porque tem dois traços representativos da ligação entre os dois átomos.
c) tripla porque tem apenas um traço representativo da ligação entre os dois átomos.
d) simples porque dois traços representativos da ligação entre os dois átomos.
e) dupla porque tem três traços representativos da ligação entre os dois átomos.
8) Observe na figura abaixo, o modelo representativo da formação do gás nitrogênio (N2) gás muito importante da nossa atmosfera terrestre. observe que três elétrons (pontos em vermelho) de um átomo, se aproxima de outro átomo para se ligarem e formarem o gás.
A ligação para a formação do gás nitrogênio é covalente molecular:
a) simples, porque usa apenas um elétrons de cada átomo para formar a molécula.
b) dupla, porque usa dois elétrons de cada átomo para formar a molécula.
c) tripla, porque usa três elétrons de cada átomo para formar a molécula.
d) simples, porque usa elétrons de cada molécula para formar a substância.
e) tripla, porque usa três elétrons de cada substância para formar o átomo.
9) Observe abaixo a estrutura da molécula da cafeína.
Analisando bem essa estrutura podemos dizer que essa molécula tem as seguintes ligações covalentes moleculares.
Considere:
- um traço entre os átomos ligação simples.
- dois traços entre os átomos ligação dupla.
a) 4 ligações covalentes moleculares duplas e 20 ligações covalentes moleculares simples.
b) 2 ligações covalentes moleculares duplas e 22 ligações covalentes moleculares simples.
c) 6 ligações covalentes moleculares duplas e 18 ligações covalentes moleculares simples.
d) 9 ligações covalentes moleculares duplas e 15 ligações covalentes moleculares simples.
e) 4 ligações covalentes moleculares duplas e 24 ligações covalentes moleculares simples.
Bibliografia
Ser Protagonista Química Ensino Médio 1º Ano, Volume 1. Manual do professor. Edições SM. São Paulo, 2ª edição 2013.
Química - química geral - Ricardo Feltre. Editora Moderna, 2007. Volume 1, p.136 a 155.
Química - Eduardo Fleury Mortimer, Andrea Horta Machado. Editora Scipione, 2011. Volume 1, p. 248 a 265.
Química - Antônio Sardella. Editora Ática, 2005. Volume único, p. 54 a 66.
Química o Homem e a Natureza - José Geraldo Couvre. Editora Moderna, 2000. Volume 1, p. 166 a 199.
Química na Abordagem do Cotidiano - Francisco Miragaia Peruzzo, Eduardo Leite Canto. Editora Moderna, 2008. Volume 1, p. 115 a 127.










































Nenhum comentário:
Postar um comentário