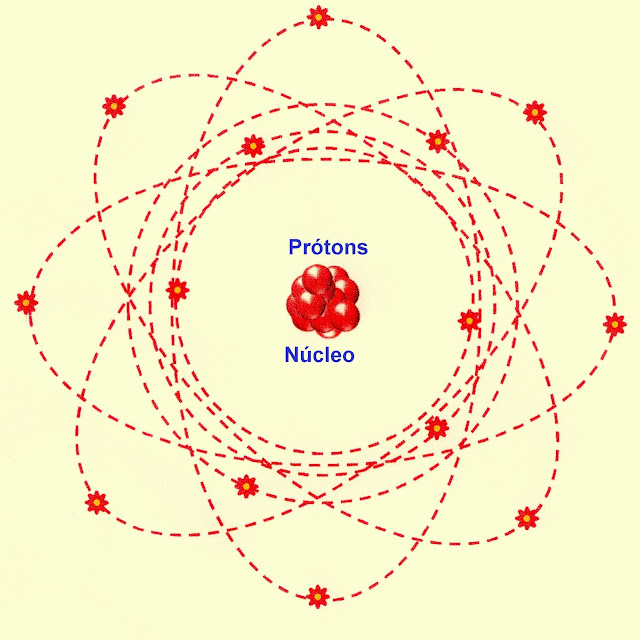
O Átomo
As Primeiras ideias Sobre o Átomo
As primeiras ideias sobre a existência de uma partícula fundamental formadora da matéria começou entre 546 e 460 a.C, na antiga Grécia pelo filósofo grego Demócrito. em 382 - 322 a.C. Aristóteles contradiz as ideias de Demócrito e afirma que a matéria era contínua e não constituída por átomos.
O Átomo de Dalton - 1808
John Dalton
As ideias sobre o átomo foram aos poucos evoluindo. Somente de 1803 a 1808, John Dalton com seus estudos, elabora a teoria que diz: toda a matéria é constituída por átomos.
A teoria de Dalton diz que; os átomos seriam partículas esféricas, maciças, indivisíveis e indestrutíveis.

Dalton e a Teoria Das Massas
Toda matéria é formada por átomos e tem massa.
Dalton com suas teorias estudando os gases propôs, que átomos de gases diferentes tem massas diferentes e gases iguais tem massas iguais.
Átomos diferentes, possuem diferentes massas e nas reações química os átomos das espécies químicas se rearranjam formando novas espécies químicas.
As ideias sobre o átomo foram aos poucos evoluindo. Somente de 1803 a 1808, John Dalton com seus estudos, elabora a teoria que diz: toda a matéria é constituída por átomos.
A teoria de Dalton diz que; os átomos seriam partículas esféricas, maciças, indivisíveis e indestrutíveis.

Dalton e a Teoria Das Massas
Toda matéria é formada por átomos e tem massa.
Dalton com suas teorias estudando os gases propôs, que átomos de gases diferentes tem massas diferentes e gases iguais tem massas iguais.
Átomos diferentes, possuem diferentes massas e nas reações química os átomos das espécies químicas se rearranjam formando novas espécies químicas.
Portanto, concluindo: os
átomos de um mesmo elemento químico são iguais, em tamanho e massa.
Também estudando a química quantitativa, associou seu conhecimento á lei de Lavoisier e de Proust, sobre as quantidades da matéria envolvidas nas transformações químicas.
Nas suas pesquisas, Dalton associou as quantidades das massas envolvidas, com os diferentes tipos de átomos nas transformações químicas, gerariam uma nova substância e concluiu que estas são recombinações de átomos.
Assim ele complementa que as transformações químicas são recombinações atômicas que formam as substâncias simples e compostas como é visto a seguir.
Também estudando a química quantitativa, associou seu conhecimento á lei de Lavoisier e de Proust, sobre as quantidades da matéria envolvidas nas transformações químicas.
Nas suas pesquisas, Dalton associou as quantidades das massas envolvidas, com os diferentes tipos de átomos nas transformações químicas, gerariam uma nova substância e concluiu que estas são recombinações de átomos.
Assim ele complementa que as transformações químicas são recombinações atômicas que formam as substâncias simples e compostas como é visto a seguir.
 |
| Átomos iguais |
Os
átomos de diferentes elementos químicos são diferentes entre si em massa e volume e possuem propriedades físicas e químicas diferentes.
 |
| Átomos diferentes |
Dalton e a Combinação de Átomos Diferentes
Dalton eleborou a combinação dos átomos nas fórmulas segundo o esquema abaixo. A fórmula da água do gás carbônico, da amônia e assim por diante.
Nas fórmulas apresentadas acima os átomos diferentes se juntam e formam substâncias compostas. As substâncias compostas são formadas por dois ou mais elementos químicos diferentes como apresentadas a seguir.
 |
| A figura mostra três tipos de substâncias compostas. |
Dalton sugeriu alguns modelos estruturais e nomes de elementos químicos conhecidos na época; o hidrogênio, carbono, nitrogênio, oxigênio, alumínio, sódio, chumbo, fósforo, potassa, prata, cobre, enxofre.


O Átomo de Thomson -1887
O Átomo de Thomson é elaborado a partir do átomo de Dalton. Thomson descobre a partícula negativa que chamou de elétrons, a esfera maciça de Dalton é então aperfeiçoada com a descoberta dos elétrons com carga negativa, somou-se a sua proposta a ideia de haver também carga positiva na partícula.
Thomson elabora o átomo como uma esfera sólida com massa de carga positiva e corpúsculos de carga negativa incrustados na sua superfície, simbolizando os elétrons dispersos.
Thomson trabalhando com descargas elétricas em gases, nas suas pesquisas, já admite que os átomos são as menores partículas da matéria que podem ser divididas.
Abaixo a representação por três modelos do mesmo átomo.
Ampola de Crookes, Eugen Goldsteim
A ampola de Crookes consistia numa esfera de vidro preenchida com gás em baixa pressão cujas extremidades eram soldadas fios de metal ligados a uma fonte de alta tensão. Possuia duas placas de metal separadas uma conectada ao polo positivo denominada
ânodo e outra ligada ao polo negativo denominada Cátodo.
A ampola de Crookes foi aperfeiçoada por Eugen Goldstein e posteriormente por Joseph John Thomson, com ela conseguiram decifrar a natureza do raio catódico que era formado por feixes de partículas de carga negativa.
George Johstone Stoney
Finalmente em 1897 George Johstone Stoney deu o nome para as partículas de carga negativa chamando-as de elétrons. Portanto com essa ampola e com diversos experimentos, foram descobertos os elétrons.
Raios Catódicos
Raios catódicos são radiações produzidas por elétrons. Nesse caso os elétrons são "gerados" ou arrancados do cátodo por causa da tensão potencial elétrica, esse processo acontece no interior de um recipiente fechado contendo um gás rarefeito, portanto essa radiação, é causada pelos feixes de elétrons que se deslocam do eletrodo negativo o cátodo, para o eletrodo positivo, o ânodo, devido a diferença de potencial.
O Átomo de Rutherford - 1911
Rutherford imaginou o átomo semelhante ao sistema solar, com uma região constituída por um núcleo sólido de carga positiva e outra região distante do núcleo, que constituía uma eletrosfera com elétrons de carga negativa, com grandes espaço vazios, onde circulavam esses elétrons nos seus orbitais.
Ele também conseguiu provar com seus experimentos, a existência de espaços enormes entre os átomos mais próximos um do outro, por onde passavam livremente as radiações. Já havia sido postulada a teoria de uma partícula presente no núcleo com carga neutra que estabilizaria a estrutura atômica.
O modelo atômico de Rutherford pode ser esquematizado como os abaixo.
O Átomo de Bohr -1913
O dinamarquês Niels Bohr em 1913 ajudado por Rutherford publica a teoria atômica no princípio da quantização de energia já pensada por Planck, que diz que os elétrons absorvem e emitem quantidades, ou energia quântica, fixas de energia.
Bohr estudando o espectro emitido pela luz de átomos com maior número de elétrons, observou que formavam conjunto de linhas que foi chamado de espectro de raias. Com isso explicava que os elétrons podiam estar situados num mesmo nível ou camada eletrônica, quando excitados emitiam luz com propriedades próprias e próximas numa mesma faixa ou camada.
As Camadas Eletrônicas de Bohr
Bohr elaborou a teoria das camadas eletrônicas de orbitais de um átomo com muitos elétrons, cujo centro ficava o núcleo.
A primeira camada eletrônica ficaria a mais próxima do núcleo denominada de camada K com apenas um orbital com 2 elétrons.
A segunda camada denominada pela letra L possuiria 4 orbitais com 8 elétrons.
Bohr separou os elétrons
em 7 níveis de energia ou 7 camadas eletrônicas. Cada nível possui seu próprio valor de energia.
As sete camadas eletrônicas conforme o nível de energia de cada uma e o número de elétrons de cada camada.
O Átomo de Bohr e a Produção da Luz
A teoria da produção da luz pode ser explicada, pela teoria dos níveis eletrônicos de Bohr. Por exemplo: o elétron que está no nível eletrônico mais externo ao receber energia, seja elétrica, térmica etc, migra para um orbital mais interno do átomo. Quando cessa essa energia, o elétron volta á sua órbita original e libera fóton (luz em cores), libera energia na forma de calor, microondas, (raios infravermelhos), raios X, radiação ultravioleta. Todos esses tipos de emissões feitas pelos elétrons são eletromagnéticas.
A figura abaixo mostra o esquema da produção da luz.
O Salto do Elétron e a Cor da Luz Emitida
O salto dos elétrons de uma órbita bem
definida para outra, definem o espectro descontínuo da luz em forma de raias. Num átomo com
vários orbitais, por exemplo 4 orbitais. Se o elétron saltar da quarta órbita
que é a mais externa para o primeiro orbital que é o mais interno, libera luz
da cor azul. Se o elétron saltar do terceiro orbital para o primeiro, que é o mais
interno, libera luz da cor verde, Se o elétron saltar da segunda órbita mais
interna, para o primeiro orbital mais interno, libera luz da cor vermelha.
Observe o esquema abaixo.
Ondas de fótons e as Cores da Luz
Com o salto dos elétrons nos orbitais dos seus átomos, há a liberação dos fótons, que se juntam em diferentes comprimentos de ondas, na formação da luz de várias cores.
Brinquedos que Emitem Luz no Escuro
A teoria de Bohr pode ser demonstrada em alguns brinquedos como pulso mão, take dance Party, dinner party glow, in the dark romance, e outros que emitem luz brilhante no escuro. Alguns desses artefatos contém por exemplo; sulfeto de zinco. Os elétrons desses átomos no claro, absorvem a energia luminosa e saltam para níveis de energia, ou orbitais mais internos. Quando no escuro os elétrons cessam de absorver energia luminosa, e voltam para seus orbitais de origem, ou seja mais externos, liberando a energia luminosa que faz o brinquedo brilhar.
As Teorias de Rutherford Bohr Nos Fogos de Artifício.
Fogos de artifício utilizam íons metálicos como sais de sódio, bário, cobre, para produzirem diferentes cores quando queimados. Conforme as teorias de Rutherford e Bohr, pelo processo de deslocamento do elétron de níveis de menor energia (externo), para níveis de maior energia (interno), e subsequente volta dos mesmos aos seus orbitais de origem, liberando as cores; amarelo para o sódio, verde para para o bário e azul para o cobre.
O Fóton - Max Planck e Einstein
Em 1900 Max Planck determinou a energia luminosa quantizada, ou ainda pacotes de energia determinadas. O fóton sendo descrito por Albert Einstein em 1905, seria uma partícula de luz que se trataria de um corpúsculo. O mesmo chegou a conclusão com seus trabalhos, que o fóton é capaz de arrancar elétrons dos orbitais de um átomo de uma superfície metálica. Com isso ele também explica o efeito fotoelétrico (emissão de elétrons). Arthur Holly Compton, em 1923 deduziu que quando essas partículas de luz se chocam com partículas lambda um corpo pode se espalhar para outras direções, com diminuição de energia e aumento do comprimento de onda. Somente em 1926 o químico Gilbert Lewis, sugeriu o nome para a partícula de luz o nome fóton.
O Átomo de Moseley -1913
O Inglês e físico Henry G. J. Moseley descobriu que quando os átomos eram bombardeados com raios catódicos, emitiam raios X. Com a emissão do espectro de raios X proporcional ao determinado átomo testado, conseguiu determinar especificamente o número de prótons do núcleo e com isso o seu número atômico.
O Átomo de Sommerfeld
O Modelo do Átomo de Sommerfeld - 1916
As Sub-camadas
Arnold Sommerfeld estudando o espectro emitido pela luz, idealizou as sub-camadas s, p,d, f dos átomos. Segundo Sommerfeld as camadas do espectro da luz de Bohr, que possuiam linhas divisórias, estas, também seriam formadas por múltiplas linhas justapostas que levou o pesquisador a formular a teoria das subcamadas.
A camada K, possuiria somente um subnível, s.
A camada L, possuiria dois subníveis, s e p.
A camada M possuiria as subcamadas s, p, e d. E assim por diante.
Os Subníveis Eletônicos de Sommerfeld
Sommerfeld concluiu que os subníveis quanto mais se distanciavam do núcleo, mais eles se tornavam elípticos. Por exemplo, o subnível s (sharp ou nítida) seria circular, o subnível p (principal) já sofreria uma pequena variação se transformando numa elipse curta, o subnível d (diffuse) formaria uma elipse média e o subnível f (fine = fino) formaria uma elipse longa.
As subcamadas podem ser representadas do modo esquematizado abaixo.
Para os átomos maiores, o número máximo de orbitais e elétrons de cada subnível pode ser esquematizado conforme a tabela abaixo.
Broglie e os Elétrons em Ondas - 1924
Observações do Francês Lois de Broglie, levaram-no a considerar o relacionamento do deslocamento das ondas de radiações com os elétrons. Segundo ele haveria um paralelismo entre fóton e elétron. Com sua hipóteses ele chegou a concluir que o elétron teria dois comportamentos. Dependendo do modo que se trabalhe com ele, em dado momento ele seria uma partícula e noutro seria uma onda, apresentando um comportamento dual, portanto os elétrons apresentariam comportamento ondulatório e não seria simplesmente uma bolinha que se deslocaria numa linha reta.
Heisenberg e a Posição e Velocidade do Elétron - 1926
Erwin Schrodinger, concluiu finalmente que o elétron é uma partícula onda que se desloca no espaço. O orbital seria a região ao redor do núcleo de um átomo onde haveria a probabilidade certa de se encontrar o elétron. Heisenberg trabalhou com o princípio da incerteza. Segundo ele é impossível saber a posição de um elétron e a sua velocidade num mesmo instante. Os elétrons num orbital estariam em todos os lugares ao mesmo tempo no mesmo orbital.
O Átomo de Chadwick - 1932
Um átomo com prótons nêutrons e elétrons
Chadwick professor de física, trabalhando com o bombardeamento do berílio com radiação alfa, descobriu que esta produzia uma radiação desconhecida que saia desse elemento químico. Era um tipo de radiação mais profunda e neutra, então concluiu que essa radiação era uma partícula neutra que seria arrancado do núcleo do átomo e denominou de nêutron.
Visão Atual do Átomo - 1980
Em 1980, já havia sido desenvolvido o microscópio de tunelamento (STM = Scanning Tunneling Microscope). Com ele pode-se fazer a varredura da superfície de um sólido a nível atômico, enxerga-se um borrão que se define como o átomo.
A partir desse modelo tecnológico, apareceram outros modelos com o qual se faz a pesquisa do átomo. Microscópio de Força Atômica (AFM - Atomic Force Microscope) ou, ainda, SFM (Scanning Force Microscope).
O átomo atual é um intricado de partículas e sub partículas. No centro estariam os prótons e nêutrons formados pelos quarks e na periferia do átomo estariam os elétrons em constante movimentos.
Esquema representativo do átomo atual.
Divisão dos Elementos
A Massa Dos Átomos
A massa dos átomos é a soma de seus prótons e nêutrons do núcleo. Por exemplo observe o esquema representativo do átomo de oxigênio abaixo.
O número atômico do átomo de hélio.
O número atômico do átomo de boro.
Número de Nêutrons dos Átomos (N)
O número de nêutrons de um átomo é dada pela subtração do número de prótons da sua massa.
Exemplo
Número de nêutrons do hidrogênio (H).
Número de nêutrons do sódio (Na).
Número de nêutrons do ferro (Fe).
Número de nêutrons do nióbio (Nb).
Número de nêutrons do mercúrio (Hg).
Questões
1) É correto dizer que; Dalton com a sua teoria idealizou o átomo como:
a) corpos eletricamente neutros, mas com determinados números de elétrons e prótons que balanceariam a sua força energética positiva e negativa.
b) um pudim de passas, indivisíveis e indestrutíveis.e que os átomos diferentes, possuiriam diferentes massas e os de um mesmo elemento seriam iguais.Broglie e os Elétrons em Ondas - 1924
Observações do Francês Lois de Broglie, levaram-no a considerar o relacionamento do deslocamento das ondas de radiações com os elétrons. Segundo ele haveria um paralelismo entre fóton e elétron. Com sua hipóteses ele chegou a concluir que o elétron teria dois comportamentos. Dependendo do modo que se trabalhe com ele, em dado momento ele seria uma partícula e noutro seria uma onda, apresentando um comportamento dual, portanto os elétrons apresentariam comportamento ondulatório e não seria simplesmente uma bolinha que se deslocaria numa linha reta.
Heisenberg e a Posição e Velocidade do Elétron - 1926
Erwin Schrodinger, concluiu finalmente que o elétron é uma partícula onda que se desloca no espaço. O orbital seria a região ao redor do núcleo de um átomo onde haveria a probabilidade certa de se encontrar o elétron. Heisenberg trabalhou com o princípio da incerteza. Segundo ele é impossível saber a posição de um elétron e a sua velocidade num mesmo instante. Os elétrons num orbital estariam em todos os lugares ao mesmo tempo no mesmo orbital.
O Átomo de Chadwick - 1932
Um átomo com prótons nêutrons e elétrons
Chadwick professor de física, trabalhando com o bombardeamento do berílio com radiação alfa, descobriu que esta produzia uma radiação desconhecida que saia desse elemento químico. Era um tipo de radiação mais profunda e neutra, então concluiu que essa radiação era uma partícula neutra que seria arrancado do núcleo do átomo e denominou de nêutron.
Visão Atual do Átomo - 1980
Em 1980, já havia sido desenvolvido o microscópio de tunelamento (STM = Scanning Tunneling Microscope). Com ele pode-se fazer a varredura da superfície de um sólido a nível atômico, enxerga-se um borrão que se define como o átomo.
A partir desse modelo tecnológico, apareceram outros modelos com o qual se faz a pesquisa do átomo. Microscópio de Força Atômica (AFM - Atomic Force Microscope) ou, ainda, SFM (Scanning Force Microscope).
O átomo atual é um intricado de partículas e sub partículas. No centro estariam os prótons e nêutrons formados pelos quarks e na periferia do átomo estariam os elétrons em constante movimentos.
Esquema representativo do átomo atual.
 |
| O átomo atual é um intricado de partículas e sub partículas |
Divisão dos Elementos
Os elementos químicos agrupados como
substância, podiam ser divididos mas não perdiam a sua identidade
. Veja exemplo
A massa dos átomos é a soma de seus prótons e nêutrons do núcleo. Por exemplo observe o esquema representativo do átomo de oxigênio abaixo.
A massa é a soma dos prótons mais nêutrons do núcleo do átomo.
Exemplos
A massa do hélio (He).
A massa do oxigênio (O).
A massa do níquel (Ni).
A massa do iodo (I).
A massa do tungstênio (W).
Cálculo do Número Atômico Dos Átomos
O esquema figurativo abaixo mostra apenas os prótons ou a partícula de carga positiva do núcleo de um átomo qualquer.
Calcular o número atômico dos átomos é o número de massa subtraído pelo número de nêutrons do átomo.
Dados:
A = massa.
Z = número atômico.
N = número de nêutrons.
e = Número de elétrons.
O número atônico do átomo de hidrogênio.
O número atômico do átomo de hélio.
O número atômico do átomo de boro.
Número de Nêutrons dos Átomos (N)
O número de nêutrons de um átomo é dada pela subtração do número de prótons da sua massa.
Exemplo
Número de nêutrons do hidrogênio (H).
Número de nêutrons do sódio (Na).
Número de nêutrons do ferro (Fe).
Número de nêutrons do nióbio (Nb).
Número de nêutrons do mercúrio (Hg).
1) É correto dizer que; Dalton com a sua teoria idealizou o átomo como:
a) corpos eletricamente neutros, mas com determinados números de elétrons e prótons que balanceariam a sua força energética positiva e negativa.
c) partícula esférica de carga positiva, com corpúsculos de cargas negativas dispersas na sua massa, indivisíveis e indestrutíveis.
d) partículas com duas regiões, uma com a eletrosfera com uma quantidade de elétrons de carga negativa, e outra com um núcleo sólido de carga positiva constituída por prótons.
e) partículas esféricas, maciças, indivisíveis e indestrutíveis. Afirmou que que os átomos diferentes, possuiriam diferentes massas e os de um mesmo elemento seriam iguais.
2) Sobre Dalton e a sua teoria sobre as massas dos elementos químicos podemos dizer que átomos de:
a) diferentes elementos químicos são iguais, em tamanho e massa.
b) um mesmo elemento químico são iguais, em tamanho e massa.
c) elementos químicos iguais, são diferentes em peso e densidade.
d) um mesmo elemento químico gasoso são diferentes quanto ao volume.
e) elementos químicos diferentes podem formar substâncias simples.
a) as transformações dos átomos são recombinações da matéria.
b) as transformações da matéria são divisões de átomos.
c) as transformações da matéria são recombinações de átomos.
d) as transformações da matéria são transformações de átomos.
e) as recombinações da matéria formam átomos diferentes.
4) Thomson elabora o átomo como uma esfera sólida, com massa:
a) de carga negativa e corpúsculos de carga positiva incrustados na sua superfície.
b) sem carga e corpúsculos positivos incrustados na sua superfície.
c) de carga positiva e corpúsculos sem carga, incrustados na sua superfície.
d) de carga positiva e corpúsculos de carga negativa incrustados na sua superfície.
e) de carga positiva e corpúsculos de carga neutra incrustados na sua superfície.
5) Umas das teorias sobre o átomo de Thomson é que o átomo é a:
a) menor porção em que pode ser dividido um elemento químico.
b) maior parte em que pode ser dividida a matéria.
c) menor porção que não pode ser dividido um elemento químico.
d) grande porção em que pode ser associado os elementos químicos.
e) menor quantia da divisão de um elemento químico.
6) A ampola de Crookes foi aperfeiçoada por Eugen Goldstein e posteriormente por Joseph John Thomson. Com ela conseguiram decifrar:
a) os isótopos de hidrogênio cujas massas eram diferentes um do outro.
b) a natureza dos raios solares que era formado por feixes de partículas positivas.
c) a natureza do raio anódico, que era formado por feixes de partículas de carga negativa.
d) a natureza do raio catódico, que era formado por feixes de partículas de carga positiva.
e) a natureza do raio catódico, que era formado por feixes de partículas de carga negativa.
7) Raios catódicos são radiações produzidas por elétrons. Os elétrons são "gerados" ou arrancados do cátodo por causa da diferença de potencial, esse processo acontece no interior de um recipiente fechado contendo um gás rarefeito, portanto, são feixes de elétrons que se deslocam do eletrodo negativo o cátodo, para o:
a) eletrodo negativo, o ânodo, devido a queda de potencial.
b) eletrodo positivo, o cátodo, devido o aumento de potencial.
c) eletrodo positivo, o ânodo, devido a diferença de potencial.
b) eletrodo negativo, o ânodo, devido ao aquecimento.
e) eletrodo negativo, o cátodo, devido ao desaparecimento do potencial.
8) Em 1897, George Johstone Stoney deu o nome para as partículas de carga:
a) positivas, chamando-as de positrons.
b) neutra, chamando-as de nêutrons.
c) positiva, chamando-as de prótons.
d) negativa, chamando-as de elétrons.
e) positiva, chamando-as de número atômico.
9) Rutherford imaginou o átomo semelhante ao sistema solar, com uma região constituída por um núcleo sólido de carga:
a) negativa e outra região distante do núcleo, que constituía uma eletrosfera com elétrons de carga positiva.
b) positiva e outra região distante do núcleo, que constituía uma eletrosfera com elétrons de carga negativa.
c) neutra e outra região distante do núcleo, que constituía uma eletrosfera com elétrons sem carga.
d) negativa e outra região distante do núcleo, que constituía uma eletrosfera com elétrons de carga negativa.
e) positiva e outra região distante do núcleo, que constituía uma eletrosfera com elétrons de carga positiva.
10) Rutherford com seus experimentos, também conseguiu provar, a existência de espaços vazios enormes, entre os átomos mais próximos um do outro por onde passavam:
a) a luz de espectro colorido.
b) o ar circulando.
c) as radiações.
d) os orbitais de outro átomo.
e) os raios X.
11) Bohr estudando o espectro emitido pela luz de átomos com maior número de elétrons, observou que formavam conjunto de linhas que foi chamado de espectro de raias. Com isso explicava que os elétrons podiam estar situados:
a) num mesmo orbital.
b) num mesmo nível ou camada eletrônica.
c) numa mesma faixa do espectro da luz.
d) em níveis diferentes de radiação infravermelha.
e) em níveis opostos das camadas eletrônicas.
12) Segundo Sommerfeld as camadas do espectro da luz de Bohr, que possuiam linhas divisórias, estas também seriam formadas por múltiplas linhas justapostas que levou o pesquisador a formular a teoria:
a) atômica.
Ricardo Feltre, Química Geral. Volume 1, 6ª edição. Editora moderna, São Paulo 2004.
Tito & Canto, Química Na Abordagem Do Cotidiano. Volume 1, Editora moderna 2ª edição 1999.
Lia Monguilhott Bezerra, Julio C Foschini Lisboa, Aline T. Bruni, Ana Luiza P. Nery, Rodrigo M Liegel, Vera L Mitiko Aoki. Ser Protagonista, Química Volume 1, Edições SM, Ensino médio, 3ª edição, São Paulo 2016.
Victor Nehmi. Química Geral e Atomística, Volume 1, 5ª edição, Editora Ática, São Paulo 1995.
Francisco Miragaia Peruzzo, Eduardo Leite do Canto. Química na Abordagem do Cotidiano. Volume 1, Química Geral e Inorgânica. Editora Moderna 3ª Edição São Paulo 2003.
Eduardo Fleury Mortimer, Andrea Horta Machado. Química, Ensino Médio, Editora Scipione 3ª edição, São Paulo 2017.
Caderno do Aluno e do Professor, Ciências da Natureza. 1ª Série, Ensino Médio, volume 1
Nova Edição, 2014-2017 São Paulo.
Magno Urbano de Macedo, Antonio Carvalho. Química, Coleção Horizontes, IBEP, São Paulo
João Usberco, Edgard Salvador. Quimica. Volume único, quinta edição, 2003. Editora Saraiva
b) as transformações da matéria são divisões de átomos.
c) as transformações da matéria são recombinações de átomos.
d) as transformações da matéria são transformações de átomos.
e) as recombinações da matéria formam átomos diferentes.
4) Thomson elabora o átomo como uma esfera sólida, com massa:
a) de carga negativa e corpúsculos de carga positiva incrustados na sua superfície.
b) sem carga e corpúsculos positivos incrustados na sua superfície.
c) de carga positiva e corpúsculos sem carga, incrustados na sua superfície.
d) de carga positiva e corpúsculos de carga negativa incrustados na sua superfície.
e) de carga positiva e corpúsculos de carga neutra incrustados na sua superfície.
5) Umas das teorias sobre o átomo de Thomson é que o átomo é a:
a) menor porção em que pode ser dividido um elemento químico.
b) maior parte em que pode ser dividida a matéria.
c) menor porção que não pode ser dividido um elemento químico.
d) grande porção em que pode ser associado os elementos químicos.
e) menor quantia da divisão de um elemento químico.
6) A ampola de Crookes foi aperfeiçoada por Eugen Goldstein e posteriormente por Joseph John Thomson. Com ela conseguiram decifrar:
a) os isótopos de hidrogênio cujas massas eram diferentes um do outro.
b) a natureza dos raios solares que era formado por feixes de partículas positivas.
c) a natureza do raio anódico, que era formado por feixes de partículas de carga negativa.
d) a natureza do raio catódico, que era formado por feixes de partículas de carga positiva.
e) a natureza do raio catódico, que era formado por feixes de partículas de carga negativa.
7) Raios catódicos são radiações produzidas por elétrons. Os elétrons são "gerados" ou arrancados do cátodo por causa da diferença de potencial, esse processo acontece no interior de um recipiente fechado contendo um gás rarefeito, portanto, são feixes de elétrons que se deslocam do eletrodo negativo o cátodo, para o:
a) eletrodo negativo, o ânodo, devido a queda de potencial.
b) eletrodo positivo, o cátodo, devido o aumento de potencial.
c) eletrodo positivo, o ânodo, devido a diferença de potencial.
b) eletrodo negativo, o ânodo, devido ao aquecimento.
e) eletrodo negativo, o cátodo, devido ao desaparecimento do potencial.
8) Em 1897, George Johstone Stoney deu o nome para as partículas de carga:
a) positivas, chamando-as de positrons.
b) neutra, chamando-as de nêutrons.
c) positiva, chamando-as de prótons.
d) negativa, chamando-as de elétrons.
e) positiva, chamando-as de número atômico.
9) Rutherford imaginou o átomo semelhante ao sistema solar, com uma região constituída por um núcleo sólido de carga:
a) negativa e outra região distante do núcleo, que constituía uma eletrosfera com elétrons de carga positiva.
b) positiva e outra região distante do núcleo, que constituía uma eletrosfera com elétrons de carga negativa.
c) neutra e outra região distante do núcleo, que constituía uma eletrosfera com elétrons sem carga.
d) negativa e outra região distante do núcleo, que constituía uma eletrosfera com elétrons de carga negativa.
e) positiva e outra região distante do núcleo, que constituía uma eletrosfera com elétrons de carga positiva.
10) Rutherford com seus experimentos, também conseguiu provar, a existência de espaços vazios enormes, entre os átomos mais próximos um do outro por onde passavam:
a) a luz de espectro colorido.
b) o ar circulando.
c) as radiações.
d) os orbitais de outro átomo.
e) os raios X.
11) Bohr estudando o espectro emitido pela luz de átomos com maior número de elétrons, observou que formavam conjunto de linhas que foi chamado de espectro de raias. Com isso explicava que os elétrons podiam estar situados:
a) num mesmo orbital.
b) num mesmo nível ou camada eletrônica.
c) numa mesma faixa do espectro da luz.
d) em níveis diferentes de radiação infravermelha.
e) em níveis opostos das camadas eletrônicas.
12) Segundo Sommerfeld as camadas do espectro da luz de Bohr, que possuiam linhas divisórias, estas também seriam formadas por múltiplas linhas justapostas que levou o pesquisador a formular a teoria:
a) atômica.
b) das ondas eletromagnéticas.
c) da produção da luz.
d) das subcamadas.
e) das multi-camadas.
13) O Inglês e físico Henry G. J. Moseley trabalhando com a emissão do espectro de raios X proporcional ao determinado átomo testado, conseguiu determinar especificamente:
a) o número de elétrons em cada orbital do átomo.
b) o número de prótons do núcleo e com isso o seu número atômico.
c) o número de nêutrons do núcleo e com isso o seu número de massa.
d) a massa dos prótons do núcleo e com isso a emissão alfa.
13) O Inglês e físico Henry G. J. Moseley trabalhando com a emissão do espectro de raios X proporcional ao determinado átomo testado, conseguiu determinar especificamente:
a) o número de elétrons em cada orbital do átomo.
b) o número de prótons do núcleo e com isso o seu número atômico.
c) o número de nêutrons do núcleo e com isso o seu número de massa.
d) a massa dos prótons do núcleo e com isso a emissão alfa.
e) o número de massa do núcleo e com isso o seu número atômico.
14) Chadwick professor de física, trabalhando com o bombardeamento do berílio e com radiação alfa, descobriu que esta produzia uma radiação desconhecida que saia desse elemento químico. Era um tipo de radiação mais profunda e neutra, então concluiu que essa radiação era uma partícula neutra chamada de:
a) próton.
b) elétron.
c) radioatividade.
d) núcleo.
e) nêutron.
15) O fóton sendo descrito por Albert Einstein em 1905, seria uma partícula:
a) de luz ou um corpúsculo com capacidade de arrancar elétrons de seus orbitais.
b) Interatômica com capacidade de arrancar elétrons de seus orbitais.
c) ou um corpúsculo com capacidade de produzir elétrons e formar orbitais.
d) do núcleo do átomo, com capacidade de arrancar elétrons de outros átomos.
e) de luz ou um corpúsculo com capacidade de arrancar prótons do núcleo do átomo.
16) Observações de Broglie levaram-no a considerar o relacionamento do deslocamento das ondas de radiações com os elétrons que teriam dois comportamentos, o elétron:
a) num momento teria uma carga positiva e noutro negativa.
b) se deslocaria numa linha reta num sentido paralelo ao orbital.
c) num momento seria uma partícula e noutro seria uma onda.
d) num momento seria um elétron e noutro seria uma antimatéria.
e) num momento seria um coloide e noutro seria uma onda.
17) Sabe-se que o elétron é uma partícula onda que se desloca no espaço, segundo Erwin Schrodinger, o orbital seria a região ao redor:
a) de uma molécula, onde haveria a probabilidade certa de se encontrar o elétron.
b) de um próton do átomo, onde se encontrar o elétron devido a sua carga negativa.
c) do núcleo de um átomo, de se encontrar o elétron devido a atração eletromagnética.
d) do núcleo do átomo, onde haveria a probabilidade certa de se encontrar o elétron.
e) do núcleo do átomo, pois sua carga negativa atrairia o elétron.
18) Fogos de artifício utilizam íons metálicos como sais de sódio, bário, cobre, para produzirem diferentes cores quando queimados. Conforme Rutherford e Bohr, pelo processo de deslocamento do elétron de níveis de menor energia (externo), para níveis de maior energia (interno), e subsequente volta dos mesmos aos seus orbitais de origem, liberando as cores:
a) verde para o sódio, amarelo para o bário e azul para o cobre.
b) amarelo para o sódio, verde para o bário e azul para o cobre.
c) azul para o sódio, amarelo para o bário e vermelha para o cobre.
d) amarelo para o sódio, vermelha para o bário e verde para o cobre.
e) verde para o sódio, rosa para o bário e amarelo para o cobre.
Bibliografia14) Chadwick professor de física, trabalhando com o bombardeamento do berílio e com radiação alfa, descobriu que esta produzia uma radiação desconhecida que saia desse elemento químico. Era um tipo de radiação mais profunda e neutra, então concluiu que essa radiação era uma partícula neutra chamada de:
a) próton.
b) elétron.
c) radioatividade.
d) núcleo.
e) nêutron.
15) O fóton sendo descrito por Albert Einstein em 1905, seria uma partícula:
a) de luz ou um corpúsculo com capacidade de arrancar elétrons de seus orbitais.
b) Interatômica com capacidade de arrancar elétrons de seus orbitais.
c) ou um corpúsculo com capacidade de produzir elétrons e formar orbitais.
d) do núcleo do átomo, com capacidade de arrancar elétrons de outros átomos.
e) de luz ou um corpúsculo com capacidade de arrancar prótons do núcleo do átomo.
16) Observações de Broglie levaram-no a considerar o relacionamento do deslocamento das ondas de radiações com os elétrons que teriam dois comportamentos, o elétron:
a) num momento teria uma carga positiva e noutro negativa.
b) se deslocaria numa linha reta num sentido paralelo ao orbital.
c) num momento seria uma partícula e noutro seria uma onda.
d) num momento seria um elétron e noutro seria uma antimatéria.
e) num momento seria um coloide e noutro seria uma onda.
17) Sabe-se que o elétron é uma partícula onda que se desloca no espaço, segundo Erwin Schrodinger, o orbital seria a região ao redor:
a) de uma molécula, onde haveria a probabilidade certa de se encontrar o elétron.
b) de um próton do átomo, onde se encontrar o elétron devido a sua carga negativa.
c) do núcleo de um átomo, de se encontrar o elétron devido a atração eletromagnética.
d) do núcleo do átomo, onde haveria a probabilidade certa de se encontrar o elétron.
e) do núcleo do átomo, pois sua carga negativa atrairia o elétron.
18) Fogos de artifício utilizam íons metálicos como sais de sódio, bário, cobre, para produzirem diferentes cores quando queimados. Conforme Rutherford e Bohr, pelo processo de deslocamento do elétron de níveis de menor energia (externo), para níveis de maior energia (interno), e subsequente volta dos mesmos aos seus orbitais de origem, liberando as cores:
a) verde para o sódio, amarelo para o bário e azul para o cobre.
b) amarelo para o sódio, verde para o bário e azul para o cobre.
c) azul para o sódio, amarelo para o bário e vermelha para o cobre.
d) amarelo para o sódio, vermelha para o bário e verde para o cobre.
e) verde para o sódio, rosa para o bário e amarelo para o cobre.
19) O número de massa, prótons,
nêutrons e elétrons do átomo de cobre 29Cu63,5 são respectivamente:
a) 19, 34, 29, 63
b) 35,
17, 18,34
c) 29,
34, 29, 38
d) 63, 29, 34, 29
e) 52, 35, 17, 45
Ricardo Feltre, Química Geral. Volume 1, 6ª edição. Editora moderna, São Paulo 2004.
Tito & Canto, Química Na Abordagem Do Cotidiano. Volume 1, Editora moderna 2ª edição 1999.
Lia Monguilhott Bezerra, Julio C Foschini Lisboa, Aline T. Bruni, Ana Luiza P. Nery, Rodrigo M Liegel, Vera L Mitiko Aoki. Ser Protagonista, Química Volume 1, Edições SM, Ensino médio, 3ª edição, São Paulo 2016.
Victor Nehmi. Química Geral e Atomística, Volume 1, 5ª edição, Editora Ática, São Paulo 1995.
Francisco Miragaia Peruzzo, Eduardo Leite do Canto. Química na Abordagem do Cotidiano. Volume 1, Química Geral e Inorgânica. Editora Moderna 3ª Edição São Paulo 2003.
Eduardo Fleury Mortimer, Andrea Horta Machado. Química, Ensino Médio, Editora Scipione 3ª edição, São Paulo 2017.
Caderno do Aluno e do Professor, Ciências da Natureza. 1ª Série, Ensino Médio, volume 1
Nova Edição, 2014-2017 São Paulo.
Magno Urbano de Macedo, Antonio Carvalho. Química, Coleção Horizontes, IBEP, São Paulo
João Usberco, Edgard Salvador. Quimica. Volume único, quinta edição, 2003. Editora Saraiva