Entalpia Padrão
Definição
A entalpia padrão pode ser definida como a entalpia conseguida na reação de uma substância encontrada em maior proporção, e que na sua forma ou estado físico natural é a mais estável, quando observada á pressão de 1 atmosfera e temperatura de 25ºC.
Fatores Influentes Nas Reações Termoquímicas
Os fatores que influenciam na termoquímica são:
A Quantidade de Reagentes e Dos Produtos.
O Estado Físico Dos Reagentes e Produtos.
O Estado Alotrópico Das Substâncias.
O Fator Quantidade Dos Reagentes e Produtos
A quantidade dos reagentes e produtos dada em mols no mesmo estado físico, a variação da temperatura equivale a quantidade de mols ou da massa empregada.
Vejamos exemplo.
A reação de um mol de gás hidrogênio (H2) com ½ mol de gás oxigênio (O2)
gera um mol de água (H2O) no estado vapor e uma variação da temperatura ΔH -242,9 kj.
A reação de 2 mols de gás hidrogênio (H2) com 1 mol de gás oxigênio (O2) gera 2 mols de água (H2O), no estado vapor e uma variação da temperatura ΔH -485,8 kj.
Outros exemplos
1) Na reação de formação da água (H2O) no estado de vapor a partir do H2 (g) e O2(g) foi utilizado -2429 kj de energia. Pede-se para calcular o número de mols e a massa de cada reagente e produto envolvidos na reação.
Utilizando como modelo a reação:
O número de mols de gás hidrogênio (H2) será:
O número de mols de gás oxigênio (O2) será:
O número de mols de água formada será:
Utilizando como modelo a reação:
O número de mols de gás hidrogênio (H2) será:
O número de mols de gás oxigênio (O2) será:
O número de mols de água formada será:
Calculando a massa em gramas empregada na reação.
Calculando a massa do gás hidrogênio utilizada.
Calculando a massa de gás oxigênio utilizada.
Calculando a massa em gramas da água produzida.
O Estado Físico Dos Reagentes e Produtos Na Reação Altera a Variação da Entalpia
Vejamos a formação da água a partir dos gases hidrogênio (H2) e oxigênio (O) nos três diferentes estados físicos, gasoso, líquido e sólido.
Observem como varia os calores das reações.
A formação da água na forma de vapor e a variação da entalpia.
A formação da água na forma líquida e a variação da entalpia.
A formação da água na forma sólida e a variação da entalpia.
1) 100 g de água na forma gasosa se transforma em água no
estado líquido, qual é a diferença de temperatura final envolvida na mudança de
estado físico.
Influência do Estado Alotrópico
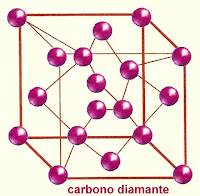
O carbono grafite e o carbono diamante são alótropos um do outro.
 Modelo estrutural do carbono grafite.
Modelo estrutural do carbono grafite. Enxofre rômbico e enxofre monoclínico também são alotropos.


Enxofre rômbico (S) figura á esquerda.
Enxofre monoclínico, (S) figura á direita.
Energia produzida na reação do enxofre rômbico.
Energia produzida na reação do enxofre monoclínico.
2) Conhecendo o valor da energia da reação do enxofre rômbico e do enxofre monoclínico, calcule a diferença da energia entre os dois tipos de enxofre.
3) Ao fazer reagir 100 g de enxofre rômbico comparou-se com a reação de 100 g de enxofre monoclínico. Qual é a diferença de energia em quilojaule (kj) entre as duas substâncias?
C2H5OH (l) + 3 O2(g) ------> 2 CO2 (g) + 3 H2O (l) ΔH = - 1,4 x 103 Kj/mol
CH4 (g) + 2 O2(g) ------> CO2 (g) + 2 H2O (l) ΔH = -0,889 x 103 Kj/mol
O gás metano (CH4) e o etanol (C2H5OH), ambos são utilizados como
combustível para veículos automotores. A 25 ºC e 1 atmosfera de pressão a massa
de metano necessária para gerar a mesma quantidade de calor liberada na
queima de 1 mol de etanol, é de aproximadamente:
5) Fuvest 2018 Questão 17 (adaptado)
Ao queimar 1 mol de etanol ocorre a
liberação de energia térmica, energia essa, provinda do sol armazenada pela
fotossíntese na produção de um mol desse álcool.
Observe o processo da fotossíntese.
6 CO2(g) +
6 H2O(g) → C6H12O6(aq)
+ 6 O2(g)
Observe o processo de produção de etanol.
C6H12O6(aq) → 2 C2H5OH(l) + 2 CO2(g) ΔH
= -70 kj/mol
Observe o processo de combustão do
etanol.
C2H5OH(l) + 3 O2(g) → 2 CO2(g) + 3 H2O(g) ΔH = -1235 kj/mol
Com base nessas informações, podemos
afirmar que o valor de ΔH
para a reação de fotossíntese é:
Resolução do problema.
b) +1305 kj/mol
c) +2400 kj/mol
d) -2540 kj/mol
e) +2540 kj/mol
6) (Enem 2018 Prova Amarela questão
108 - adaptado) Nossas células obtêm energia
por reações químicas de carboidratos, lipídios e proteínas, portanto
a oxidação
da glicose por
exemplo, no organismo
humano libera energia
que aproximadamente 40/%
dela é disponibilizada
para atividade
muscular.
Sabemos também que o resíduo do metabolismo
dessas três substâncias produz gás carbônico e água.
Observe o esquema da equação da reação do
metabolismo da glicose no interior de uma
célula.
C6H12O6 (s) + 6 O2(g) → 6 CO2
(g) + 6 H2O (l) ∆H = -2800 kj
Considere as massas molares (em g/mol-1) H = 1, C = 12, O = 16
Na oxidação de 1,0 grama de glicose, a
energia obtida para atividade muscular, em quilojoule, é mais próxima de:
a) 6,2.
b) 15,6.
c) 70,0.
d) 622,2.
e) 1.120,0.














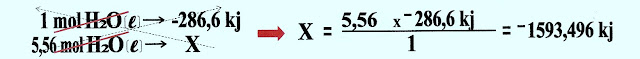

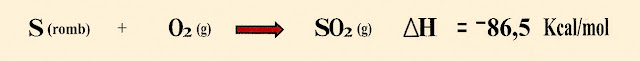







Nenhum comentário:
Postar um comentário