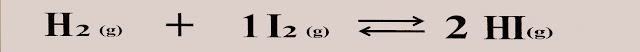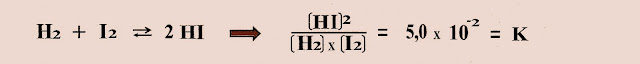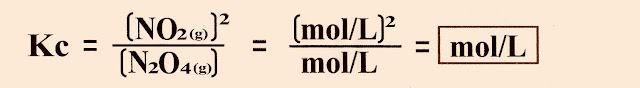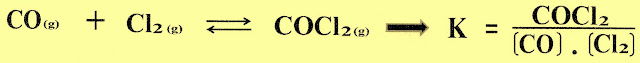Equilíbrio Químico
Conteúdo
A Definição
Exemplos de Reações em Equilíbrio.
Reações Reversíveis e não Reversíveis
Equilíbrio Químico na Natureza e no Cotidiano
A Constante de Equilíbrio K
A Unidade da Constante de Equilíbrio e Mol
Definição
O
equilíbrio químico foi
estudado pelo francês
Claude
Louis Berthollet. Acontecem
com
substâncias em
transformação, até que certos
fatores que
as influenciam permitem o seu desenvolvimento.
Essas reações possuem a capacidade de transformar o reagente em produto até
certa altura e depois começa a reverter os produtos em reagentes em proporções igualmente ao
estado inicial de antes da reação. Por esse motivo no início não há equilíbrio e as reações são chamadas de diretas, no final ocorre o equilíbrio entre os reagentes em transformação e os produtos formados que se revertem. No equilíbrio químico a reação inicialmente é direta e depois começa
a equilibrar com a reversa.
Condições
Para Haver
o Equilíbrio
O
equilíbrio químico somente é atingido num sistema fechado, onde não há troca de
matéria com o meio ambiente.
No
equilíbrio as propriedades macroscópicas, como concentração, densidade, massa e
cor, permanecem constantes.
No
equilíbrio as propriedades microscópicas do sistema como, as colisões entre
moléculas, a formação de complexos ativados, e as transformações de umas
substâncias em outras, permanecem em evolução, pois o equilíbrio é dinâmico.
O gás carbônico com água líquida, entra em equilíbrio formando ácido carbônico em meio aquoso. Essa condição de formação do ácido carbônico acontece também nas chuvas ácidas.
Reações Reversíveis e não Reversíveis
No
equilíbrio as velocidades das reações direta e inversas são iguais.
A figura abaixo mostra o esquema representativo de uma reação direta e reversa.
Os reagentes nitrogênio e hidrogênio reagem com altas pressões e temperatura e formam a amônia. Ao atingir o máximo da transformação os produtos formados sofrem reação inversa transformando nos reagentes iniciais na mesma proporção em que vai sendo formado.
Questão
A reação pode ser apresentada assim.
A figura abaixo mostra o esquema representativo de uma reação direta e reversa.
Os reagentes nitrogênio e hidrogênio reagem com altas pressões e temperatura e formam a amônia. Ao atingir o máximo da transformação os produtos formados sofrem reação inversa transformando nos reagentes iniciais na mesma proporção em que vai sendo formado.
Questão
1) Numa reação 10 mol de dióxido de
nitrogênio gasoso (NO2)(g) reagiu
formando 3 mols de tetróxido de dinitrogênio
gasoso (N2O4) (g).
Pergunta-se qual é a quantidade de reagentes não transformados na reação?
A reação pode ser apresentada assim.
Para resolver essa questão, basta você
balancear a equação e o problema estará resolvido em segundos.
Multiplique os componentes do produto 3 x 2 = 6 N e 3 x 4 = 12 O e
subtraia o valor do solvente usado, 10 - 6 = 4 como 10 x 2 = 20 - 12 = 8 O, de sobra. Como devemos ter o oxigênio na forma de (O2), dividimos 8 por 2 e teremos como resultado da sobra 4 mols de reagentes,
juntamente com os três mols do produto formado.
Veja a equação abaixo.
Exemplos de Reações em Equilíbrio
Reação do gás nitrogênio, com gás hidrogênio para a formação da amônia.
A mesma reação pode ser escrita assim. No equilíbrio há 50% de reagentes, 50% de produtos que se transforma em 50% de reagentes novamente.
A reação de carbonato de cálcio com gás carbônico e água, forma cálcio ionizado e carbonato ácido iônico.
O carbonato de cálcio com ácido carbônico forma as estalactites.
O ácido acético (vinagre) se decompõe e entra em equilíbrio com hidrogênio ionizado e acetato ionizado.
O anidrido sulfúrico se decompõe e entra em equilíbrio com anidrido sulfuroso e gás oxigênio.
O tetróxido de dinitrogênio juntamente com a hidrazina é um excelente combustível propelente para foguetes, reage entrando em equilíbrio com dióxido de nitrogênio.
O sulfato de ferro com hidróxido de sódio reagem e entram em equilíbrio com o sulfato de sódio e hidróxido de ferro.
Reações Reversíveis e não Reversíveis
Reações não Reversíveis
As reações não reversíveis se processam num único sentido. São reações completas, na qual é consumido todo o reagente que é transformado em produto final. As reações de combustão são exemplos bem característicos.
Reação de combustão do metano.
Reação de combustão do etanol.
Reação de combustão do octano (gasolina).
Reações Reversíveis - Estado de Equilíbrio
As reações reversíveis são processadas nos dois sentidos, ou seja; a reação direta se processa até começar a reverter e vai aumentando a transformação reversa do produto em reagente, até chegar a um ponto de equilíbrio.
Os reagentes e produtos estão em fases diferentes.
Reação - Carbonato ácido de sódio, em equilíbrio com carbonato de sódio, gás carbônico e água.
Observe que o carbonato ácido de sódio, reagente; está na fase sólida, enquanto que os produtos, carbonato de sódio está na fase sólida, o gás carbônico está na fase gasosa e a água está na fase gasosa também.
Equilíbrio Químico na Natureza e no Cotidiano Humano
Equilíbrio Em Lâmpadas.
As reações não reversíveis se processam num único sentido. São reações completas, na qual é consumido todo o reagente que é transformado em produto final. As reações de combustão são exemplos bem característicos.
Reação de combustão do metano.
Reação de combustão do etanol.
Reações Reversíveis - Estado de Equilíbrio
As reações reversíveis são processadas nos dois sentidos, ou seja; a reação direta se processa até começar a reverter e vai aumentando a transformação reversa do produto em reagente, até chegar a um ponto de equilíbrio.
Equilíbrios Homogêneos
Os reagentes e produtos estão na mesma
fase. Observe na equação abaixo que tanto os reagentes como os produtos estão na fase gasosa. Exemplos:
O sulfito se transforma e entra em equilíbrio com o anidrido sulfuroso e gás oxigênio.
O sulfito se transforma e entra em equilíbrio com o anidrido sulfuroso e gás oxigênio.
O ácido acético aquoso na reação entra em equilíbrio com hidrogênio ionizado aquoso e o acetato ionizado aquoso.
Equilíbrios Heterogêneos
Os reagentes e produtos estão em fases diferentes.
Reação - Carbonato ácido de sódio, em equilíbrio com carbonato de sódio, gás carbônico e água.
Observe que o carbonato ácido de sódio, reagente; está na fase sólida, enquanto que os produtos, carbonato de sódio está na fase sólida, o gás carbônico está na fase gasosa e a água está na fase gasosa também.
O carbonato de cálcio sólido entra em equilíbrio com gás carbônico gasoso e óxido de cálcio sólido.
Equilíbrio Químico na Natureza e no Cotidiano Humano
Equilíbrio
Químico na Camada de Ozônio.
A
camada de ozônio protetora da atmosfera terrestre, contra os raios ionizantes, ou seja; os raios ultravioleta provindos do sol. Ela está situada a uma altitude de 20 a 35
quilômetros da atmosfera terrestre. Nessa altitude ocorre o
equilíbrio dinâmico e contínuo entre oxigênio (O2)
e ozônio (O3)
conforme a reação:
Esquema mostrando os dois gases o oxigênio e o ozônio na atmosfera terrestre.
Equilíbrio Em Lâmpadas.
O equilíbrio químico também acontece nas lâmpadas halogenas. Geralmente são lâmpadas
incandescentes com filamento de tungstênio, mergulhado num gás inerte. O interior da lâmpada é preenchido também com bromo ou iodo gasosos. A reação se dá da seguinte forma: com a alta temperatura do filamento o iodo evapora se combina com o tungstênio também na forma de vapor, a
mais ou menos 1400 ºC,
formando iodeto de tungstênio que circula dentro da lâmpada. O iodeto de tungstênio com movimentos se aproxima
novamente do filamento de tungstênio e ocorre a separação do iodo do tungstênio que volta novamente para
o filamento de tungstênio da lâmpada. Assim o ciclo se repete por muito tempo até o filamento se queimar. Observe a reação:
1ª etapa
O tungstênio sólido com o aquecimento se transforma no estado gasoso.
1ª etapa
O tungstênio sólido com o aquecimento se transforma no estado gasoso.
Equilíbrio
Químico Na Ingestão de Remédios.
Ácido acetil salicílico.
A formação de estalactites
Equilíbrio Químico Nos Dentes.
Também pode ser representado pela equação.
Equilíbrio Químico no Estômago.
Equilíbrio Químico no Água Gasosa e Refrigerantes
Ácido acetil salicílico.
Formação das Cavernas
Há dois pontos importantes a salientar. Um é a formação de uma caverna e outro é a formação das estalactites e estalagmites.
A caverna é formada pela dissolução das rochas de calcário CaCO3. A água infiltrada no solo se combina com gás carbônico em altas concentrações aprisionado no solo e forma o ácido carbônico que acidifica a água que se infiltra e dissolve o calcário em cálcio ionizado aquoso e carbonato ácido aquoso, na forma aquosa, migra para outro local, formando um oco, ou a caverna no subsolo.
Há dois pontos importantes a salientar. Um é a formação de uma caverna e outro é a formação das estalactites e estalagmites.
A caverna é formada pela dissolução das rochas de calcário CaCO3. A água infiltrada no solo se combina com gás carbônico em altas concentrações aprisionado no solo e forma o ácido carbônico que acidifica a água que se infiltra e dissolve o calcário em cálcio ionizado aquoso e carbonato ácido aquoso, na forma aquosa, migra para outro local, formando um oco, ou a caverna no subsolo.
O
equilíbrio químico na caverna
para a formação das estalactites e estalagmites, que são constituídas de
carbonato de cálcio CaCO3, acontece do seguinte modo.
A água infiltra no solo encontra grande quantidades de gás carbônico aprisionado em altas pressões, se acidifica e passa por camadas de calcário, dissolve o calcário em cátion de cálcio ionizado bivalente Ca2+. e ânion carbonato ácido HCO31- . Consequentemente num processo reverso, a reação entra em equilíbrio químico, e o carbonato ácido de carga negativa atrai o cálcio ionizado de carga oposta, ainda em meio aquoso. E assim num processo lento de gotejamento, ocorre a liberação do gás carbônico e água que evaporam formando novamente o carbonato de cálcio sólido ou a estalactite no teto da caverna e estalagmites no piso da caverna.
Todo o processo descrito acima pode ser explicado pela seguinte equação:
A água infiltra no solo encontra grande quantidades de gás carbônico aprisionado em altas pressões, se acidifica e passa por camadas de calcário, dissolve o calcário em cátion de cálcio ionizado bivalente Ca2+. e ânion carbonato ácido HCO31- . Consequentemente num processo reverso, a reação entra em equilíbrio químico, e o carbonato ácido de carga negativa atrai o cálcio ionizado de carga oposta, ainda em meio aquoso. E assim num processo lento de gotejamento, ocorre a liberação do gás carbônico e água que evaporam formando novamente o carbonato de cálcio sólido ou a estalactite no teto da caverna e estalagmites no piso da caverna.
Todo o processo descrito acima pode ser explicado pela seguinte equação:
Equilíbrio Químico Nos Dentes.
Na boca
também acontece dissociação química. A hidroxiapatita é
insolúvel em água mas é solúvel em substância aquosa ácida como refrigerantes ácidos, alimentos ácidos e mesmo o açúcar provoca a acidez na
boca.
Também pode ser representado pela equação.
Equilíbrio Químico no Estômago.
Equilíbrio
Químico Nas Lentes Fotossensíveis.
As lentes
fotossensíveis são construídas com
cristais tetraédricos de sílica (vidro), cobre, prata e cloro. A reação se dá
em 3 etapas.
No claro - A lente
exposta á luz clara, escurece.
No escuro - A lente longe da exposição da luz direta, fica clara.
No escuro - A lente longe da exposição da luz direta, fica clara.
Equilíbrio Químico no Água Gasosa e Refrigerantes
Numa garrafa de água com gás ou refrigerante fechado em condições ambiente está em equilíbrio químico, porque não ocorrem nenhuma alteração ou mudanças de fase, nem difusão de matéria ou fluxo de energia.
No entanto ocorre a reação de equilíbrio químico entre o gás carbônico (CO2) com água (H2O) e formação de ácido carbônico (H2CO3) que se decompõe em gás carbônico (CO2) e (H2O) novamente.
Observe a reação.
Fatores Que Influenciam o Equilíbrio Químico
A Constante de Equilíbrio e Concentração (Kc) ou K
No entanto ocorre a reação de equilíbrio químico entre o gás carbônico (CO2) com água (H2O) e formação de ácido carbônico (H2CO3) que se decompõe em gás carbônico (CO2) e (H2O) novamente.
Observe a reação.
Fatores Que Influenciam o Equilíbrio Químico
A Constante de Equilíbrio e Concentração (Kc) ou K
Devemos ter em mente que a constante de equilibrio, tem uma representação simbólica que é dada pela sigla Kc. Essa constante representa a concentração ou a quantidade das substancias que reagem que é dada em mol/L. É de se entender que, quanto maior for o Kc, maior será a quantidade ou concentração de produto numa reação (s).
Concentração de Reagente/Deslocamento Para a Direita
O aumento da concentração de um reagente desloca o equilíbrio químico para a direita. A diminuição da concentração de um dos reagentes desloca o equilíbrio químico para a esquerda. Do mesmo modo, a diminuição da concentração de um produto também desloca o equilíbrio para a direita. No entanto para que possa haver equilíbrio novamente, na reação, o deslocamento deve estabilizar voltando ao normal.
Modificando a Concentração dos Reagentes
A concentração de um reagente interfere no equilíbrio químico. Num sistema formado por dois reagentes, por exemplo; de números 1 e 2, em plena reação, no equilíbrio, foi adicionado mais uma certa quantidade do reagente 2. O Sistema reagiu bruscamente saindo do equilíbrio. Logo mais o sistema reage, restabelecendo o equilíbrio novamente. A configuração representativa para o sistema ficaria assim:
A figura abaixo apresenta o gráfico da concentração em função do tempo. Esquematiza uma reação em que é adicionado mais reagente ao sistema.

Observe que com o aumento de um dos reagentes ocorre o aumento da concentração, também há um aumento proporcional no equilíbrio.
Constante de Equilíbrio no Excesso de um Dos Reagentes.
Questão para exemplificar o excesso de um dos reagentes.
1) O gás hidrogênio ( H2) reage com o gás iodo (I2), a 400 °C formando o ácido iodídrico que é utilizado na produção de iodetos orgânicos e inorgânicos e também do ácido acético ou vinagre. A reação da preparação do ácido iodídrico entra em equilíbrio por exemplo, quando 1 mol de H2 (g) reage com 2 mols de I2(g) em excesso, produzindo 1,8 mols de HI. Pergunta-se: quanto de iodo sem reagir sobrou na reação ao entrar em equilíbrio?
Veja a reação e resolução.
Sobrou 0,1 mol de H2 e 1,1 mol de I2 porque havia um mol em excesso desse último.
É observado nos dois gráficos acima, o primeiro mostra o tetróxido de dinitrogênio formando dióxido de nitrogênio, é a reação endotérmica. O valor da constante de equilíbrio (K) aumenta com a temperatura nesse processo. O segundo gráfico mostra o gás hidrogênio reagindo com bromo, é a reação exotérmica. O valor da constante de equilíbrio (K) diminui com a temperatura.
A Pressão de um Sistema e o Equilíbrio Químico
A Pressão sobre um sistema tem algum significado, somente se as substâncias participantes estiverem no estado gasoso.
Nas pressões mais altas ocorre a formação de menor quantidade de substâncias gasosas e com isso há o favorecimento de atingir o equilíbrio mais rapidamente.
O aumento da pressão favorece a formação dos produtos no sentido em que o sistema ocupa menor volume, então o deslocamento do equilíbrio ocorre no sentido de diminuir a pressão.
A diminuição da pressão favorece a reação inversa do sistema que ocupa o maior volume.
Catalisador e o Deslocamento do Equilíbrio
Ao adicionar um catalisador numa reação, mesmo que este diminua a energia de ativação e aumente a velocidade da reação, não desloca o equilíbrio químico. Tanto numa reação direta ou inversa, com catalisador ou sem catalisador a massa reagente não altera o equilíbrio, que permanece igual.
A Constante de Equilíbrio e Concentração, Sem Mudança De Valor
A constante de equilíbrio para o experimento III.
Equilíbrio Químico Quando Um Dos Reagentes estão em Excesso
A Constante de Equilíbrio (K)
O aumento da concentração de um reagente desloca o equilíbrio químico para a direita. A diminuição da concentração de um dos reagentes desloca o equilíbrio químico para a esquerda. Do mesmo modo, a diminuição da concentração de um produto também desloca o equilíbrio para a direita. No entanto para que possa haver equilíbrio novamente, na reação, o deslocamento deve estabilizar voltando ao normal.
Modificando a Concentração dos Reagentes
A concentração de um reagente interfere no equilíbrio químico. Num sistema formado por dois reagentes, por exemplo; de números 1 e 2, em plena reação, no equilíbrio, foi adicionado mais uma certa quantidade do reagente 2. O Sistema reagiu bruscamente saindo do equilíbrio. Logo mais o sistema reage, restabelecendo o equilíbrio novamente. A configuração representativa para o sistema ficaria assim:
A figura abaixo apresenta o gráfico da concentração em função do tempo. Esquematiza uma reação em que é adicionado mais reagente ao sistema.

Observe que com o aumento de um dos reagentes ocorre o aumento da concentração, também há um aumento proporcional no equilíbrio.
Constante de Equilíbrio no Excesso de um Dos Reagentes.
Questão para exemplificar o excesso de um dos reagentes.
Veja a reação e resolução.
Sobrou 0,1 mol de H2 e 1,1 mol de I2 porque havia um mol em excesso desse último.
Equilíbrio Químico e a Temperatura
Com o aumento da temperatura de uma reação em um sistema fechado, ocorre o deslocamento do equilíbrio.
Observe que nesse caso o aumento da temperatura produz a queda da produção da amônia. O aumento da pressão causa o aumento da produção da amônia.
Esses valores apresentados na tabela logo acima, são os pontos em que a produção da amônia entra em equilíbrio.
Equilíbrio Químico Nas Reações Exotérmicas e Endotérmicas
Tomamos como exemplo o tetróxido de dinitrogênio em equilíbrio em condições e temperatura ideal, 1 mol da substância em 1 L a 100 ºC. Processo é endotérmico, o ΔH é positivo.
Observe a reação do tetróxido de dinitrogênio.
Abaixo são mostrados dois gráficos, de duas reações diferentes em que apresentam uma reação endotérmica e outra reação exotérmica.
Com o aumento da temperatura de uma reação em um sistema fechado, ocorre o deslocamento do equilíbrio.
Observe que nesse caso o aumento da temperatura produz a queda da produção da amônia. O aumento da pressão causa o aumento da produção da amônia.
Esses valores apresentados na tabela logo acima, são os pontos em que a produção da amônia entra em equilíbrio.
Equilíbrio Químico Nas Reações Exotérmicas e Endotérmicas
Tomamos como exemplo o tetróxido de dinitrogênio em equilíbrio em condições e temperatura ideal, 1 mol da substância em 1 L a 100 ºC. Processo é endotérmico, o ΔH é positivo.
Abaixo é dada uma tabela de reações do tetróxido de dinitrogênio em várias temperaturas diferentes. Observe que em cada temperatura a constante de equilíbrio K é diferente. Portanto com a variação do ΔH positivo devido ao aquecimento, ocorre o aumento da constante de equilíbrio (K).
Tetróxido de Dinitrogênio Reagindo em Várias Temperaturas
É observado nos dois gráficos acima, o primeiro mostra o tetróxido de dinitrogênio formando dióxido de nitrogênio, é a reação endotérmica. O valor da constante de equilíbrio (K) aumenta com a temperatura nesse processo. O segundo gráfico mostra o gás hidrogênio reagindo com bromo, é a reação exotérmica. O valor da constante de equilíbrio (K) diminui com a temperatura.
A Pressão de um Sistema e o Equilíbrio Químico
A Pressão sobre um sistema tem algum significado, somente se as substâncias participantes estiverem no estado gasoso.
Nas pressões mais altas ocorre a formação de menor quantidade de substâncias gasosas e com isso há o favorecimento de atingir o equilíbrio mais rapidamente.
O aumento da pressão favorece a formação dos produtos no sentido em que o sistema ocupa menor volume, então o deslocamento do equilíbrio ocorre no sentido de diminuir a pressão.
A diminuição da pressão favorece a reação inversa do sistema que ocupa o maior volume.
Catalisador e o Deslocamento do Equilíbrio
Ao adicionar um catalisador numa reação, mesmo que este diminua a energia de ativação e aumente a velocidade da reação, não desloca o equilíbrio químico. Tanto numa reação direta ou inversa, com catalisador ou sem catalisador a massa reagente não altera o equilíbrio, que permanece igual.
Variação da Rapidez da Reação
Até o Equilíbrio
No início de uma reação, a rapidez
do consumo do reagente é rápida e a rapidez da inversão do produto é muito lenta.
A medida que a reação continua sendo efetuada, vai diminuindo a rapidez da transformação do reagente e vai aumentando a rapidez da reversão do produto.
Finalmente a rapidez do reagente e
do produto se igualam. É quando as reações diretas e indiretas alcançam o ponto
de equilíbrio.
O gráfico representa a rapidez do consumo do reagente e formação do produto até entrar em equilíbrio.
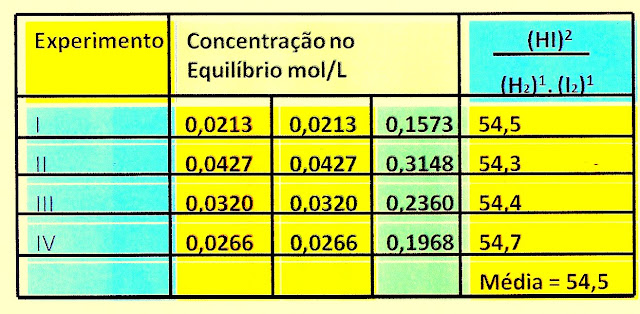
No entanto devemos considerar que a concentração de uma substância reagente não muda o valor da constante de equilíbrio. Observe a tabela representando quatro experimentos no equilíbrio da formação do iodeto de hidrogênio. Na tabela os valores são aproximadamente idênticos.
Voltando a equação:
Tabela com os quatro experimentos.
Expressando Matematicamente
os valores da tabela acima pode ser calculado conforme:
A constante de equilíbrio para o experimento I.
A constante de equilíbrio para o experimento I.
A constante de equilíbrio para o experimento II.
A constante de equilíbrio para o experimento III.
A constante de equilíbrio para o experimento IV.
Equilíbrio Químico Quando Um Dos Reagentes estão em Excesso
A Constante de Equilíbrio (K)
A Constante de Equilíbrio (K) deve ser observado conforme a temperatura, pressão utilizada na reação. No entanto mesmo que varie a concentração se não variar a temperatura e pressão a constante será a mesma para vários testes feitos com o mesmo reagente. A K é dada pela expressão:
Vejamos exemplo de aplicabilidade.
2) A reação do gás hidrogênio com o gás iodo, produzindo o gás iodeto de hidrogênio.
Conforme a reação acima montamos a equação:
Questões
2) Num sistema formado por dois reagentes, em plena reação, e em equilíbrio, foi adicionado mais uma certa quantidade de um dos reagentes. O Sistema reagiu bruscamente saindo do equilíbrio o sistema:
a) reage e para bruscamente de funcionar.
b) não reage e continua em equilíbrio normalmente.
c) reage, restabelecendo o equilíbrio novamente.
d) desequilibra e é necessário aumentar a temperatura.
e) reage, neutralizando o reagente adicionado.
3) Uma das condições para haver o equilíbrio químico entre reagentes e produtos é:
a) estar num sistema aberto, onde há troca de matéria com o meio ambiente.
b) os reagentes e produtos estarem na mesma fase.
c) no equilíbrio os reagentes e os produtos reagirem indefinidamente.
d) estar num sistema fechado, onde não há troca de matéria com o meio ambiente.
e) o produto estar concentração elevada, para que acumulado, haja revertibilidade.
4) Numa reação 10 mol de dióxido de nitrogênio gasoso (NO2)(g) reagiu formando 3 mols de tetróxido de dinitrogênio gasoso (N2O4) (g). Pergunta-se qual é a quantidade de reagentes não transformados na reação?
a) 2,0 mols.
a) 3,0 mols.
a) 4,0 mols.
a) 2,5 mols.
a) 4,5 mols.
5) O gás hidrogênio ( H2) reage com o gás iodo (I2), a 400 °C formando o ácido iodídrico, que é utilizado na produção de iodetos orgânicos e inorgânicos e também do ácido acético ou vinagre. A reação da preparação do ácido iodídrico entra em equilíbrio por exemplo, quando 1 mol de H2 (g) reage com 2 mols de I2(g) que aqui está em excesso, produzindo 1,8 mols de HI.
Pergunta-se: quanto de gás hidrogênio e gás iodo sem reagir sobrou na reação, ao entrar em equilíbrio?
a) 0,2 e 0,9
b) 0,1 e 1,1
c) 1 e 2
d) 0,2 e 0,4
e) 0,9 e 1,1
6) Sabendo que para o volume de 1 litro as concentrações de N2O4 e NO2 são respectivamente 0,74mol/L e 0,52 mol/L. Calcule o valor em gramas do produto da reação no momento em que entra em equilíbrio.
a) 2,80 g.
b) 4,20 g.
c) 8,40 g.
d) 10,20 g.
e) 8,10 g.
7) (Adaptado) O tetróxido de dinitrogênio (N2O4) é um gás poluente da atmosfera terrestre, todavia também é sinteticamente produzido a partir da oxidação catalítica da amônia para utilidade humana. Portanto, é utilizado em sínteses químicas e ainda como propelente para foguetes. Entra em equilíbrio químico conforme a equação abaixo. Qual é o valor da constante em mol, quando atinge o equilíbrio?

a) 2,10
b) 5,40
c) 22,00
d) 12,40
e) 8,00
8) Com o aumento da concentração de um reagente na reação, há o deslocamento do equilíbrio químico?
a) não, não ocorre deslocamento nenhum.
b) sim, desloca para esquerda.
c) sim, ocorre deslocamento para a direita.
d) não pode haver deslocamento, porque baixa a pressão da reação.
e) sim, para a direita quando de adiciona um catalisador.
9) Os catalisadores aumentam a velocidade das reações químicas. Ao adicionar um catalisador numa reação, mesmo que este diminua a energia de ativação e aumente a velocidade da reação este:
a) desloca rapidamente o equilíbrio químico.
b) desloca o equilíbrio químico sempre para a esquerda.
c) não desloca o equilíbrio químico, nem altera a velocidade da reção.
d) não interfere no equilíbrio químico, mas proporciona um processo exotérmico.
e) não desloca o equilíbrio químico.
10) Dada a tabela abaixo:

a) são de substâncias diferentes com valores diferentes de K.
b) são de substâncias iguais com valores iguais de K.
c) não estão no equilíbrio químico.
c) são de substâncias diferentes com valores iguais de K.
e) de combustão. portanto possuem valores de K muito alto.
Bibliografia
Química - Ciências da Natureza, Ensino Médio, 3ª série. Caderno do professor e do aluno volume 1, edição de 2017.
Química vol. 2, João Usberco, Edgard Salvador - Físico Química 13ª ed. 2014 Editora Saraiva.
Equilíbrio Químico - CCEADD PUC-Rio
web.ccead.puc-rio.br/condigital/mvsl/.../conteudo/SL_equilíbrio_quimico.pdf
Martha Reis marques da Fonseca. Química Volume 2, Meio Ambiente, Cidadania, Tecnologia. Editora FTD 1ª ed, São Paulo, 2010.
Equilíbrio Químico - proquímica
proquimica.igm.unicamp.br/introteo.htm
Química vol. 2 Ensino Médio, Eduardo Fleury Mortimer, Andrea Horta Machado, 2ª edição São Paulo, 2014. Editora Scipione.
Química o Homem e a Natureza, vol. 2 Físico Química, Jose Geraldo Covre, Editora FTD, São Paulo 2000.
Química Cidadã vol.2, Pequis - Projeto de Ensino se Química e Sociedade 2ª Ano. Wildson Luis Pereira Dos Santos, Gerson de Souza Mól, Siland Meiry França Dib, Roseli Takako Matsunaga, Sandra Maria de Oliveira Santos, Eliane Nilvana F. de Castro, Gentil de Souza Silva, Silvia Barbosa Farias. Editora AJS, São Paulo 2013, 2ª edição.
Química na Abordagem do Cotidiano. Francisco Miragaia Peruzzo, Eduardo Leite do Canto, Físico-Química, Vol 2, 4ª Edição, Editora Moderna, São Paulo 2010.
Química Na Abordagem Do Cotidiano - Tito e Canto Vol. 2, Editora Moderna, 2ª edição 1999 - São Paulo SP.
Download do arquivo - Projeto Medicina
projeto medicina. com.br/...deslocamento_de_equilíbrio_quimica_exercicios_gabarito...
Victor Nehmi. Química, Volume Único. Editora Ática, São Paulo 1995.
2) A reação do gás hidrogênio com o gás iodo, produzindo o gás iodeto de hidrogênio.
3) A mesma equação reversível da formação do iodeto de hidrogênio pode também ser representada assim: Numa temperatura de 25ºC o gás hidrogênio reage com o gás iodo conforme a expressão matemática abaixo com o valor da constante de equilíbrio correspondente a 5,0 . 10-2
4) Dada a equação química:
Expresse a equação da constante de equilíbrio na formação da amônia.
Resolvendo: a equação da constante de equilíbrio da formação da amônia fica:
Resolvendo: a equação da constante de equilíbrio da formação da amônia fica:
Reações de Substâncias Diferentes Com Valores Diferentes de K
Cada Tipo
de Reação Possui Sua Constante de equilíbrio (K). na tabela abaixo são representadas várias reações a temperatura de 25 ºC, com a expressão matemática e o valor da constante de equilíbrio de cada uma.
A Unidade de Constante de Equilíbrio (K) e Mol
A Unidade
da constante de equilíbrio (K) é o
mol/L.
Observe a reação.
Observação: Kc = K.
Observação: Kc = K.
A equação representativa fica:
a) Gás fosfogênio (COCl2), usado na 1ª guerra
mundial como gás tóxico asfixiante e corrosivo. Atualmente
é usado na fabricação
de polímeros de isocianato, de agrotóxicos, corantes e produtos farmacêuticos. O Monóxido
de carbono (CO) reagindo com gás cloro (Cl), a reação entra em equilíbrio
químico com o fosfogênio cuja
constante de equilíbrio é representado pela fórmula a seguir.
b) O dióxido
de nitrogênio (NO2) é um gás poluente e muito tóxico, produzido na combustão dos
combustíveis dos veículos automotores, nos fornos das fábricas, usinas
termelétricas, fábricas de pasta de papel. Começa sua síntese a partir do monóxido de
nitrogênio (NO) e os males causados são: irritação para os pulmões, causa
bronquite, asma, agrava problemas de infecções, causa morte súbita em bebês, e
há indícios que propicia o autismo. Agrava muitas doenças como pneumonia, enfisema pulmonar, e outros danos ao pulmão.
Colocando na equação a reação:
QuestõesColocando na equação a reação:
c) O dióxido
de enxofre (SO2) é um gás poluente emitido por veículos automotores que queimam
especialmente o diesel. As industrias que queimam combustíveis orgânicos (carvão,
petróleo), também o produzem e para o ser humano, animais e plantas é prejudicial, sendo altamente
tóxico, irritante, causa problemas para a respiração e agrava problemas
cardiovasculares. combinando com o oxigênio forma o
ácido sulfuroso e sulfúrico na atmosfera e é causador da chuva ácida. A equação representativa da reação é a seguinte:
1) (Adaptado) O anidrido sulfúrico (SO3) é
formado a partir da queima do enxofre por veículos automotores e
industrias que queimam compostos orgânicos e seus produtos são lançados na atmosfera
e se forma na presença
do oxigênio. Causa problemas respiratórios como bronquites, enfisema pulmonar,
e outras complicações como doenças cardiovasculares. Dada a reação:
Das fórmulas apresentadas abaixo, qual é
a expressão correta do Kc na
reação?
2) (Adaptado) O tetróxido de dinitrogênio (N2O4) é um gás
poluente da atmosfera terrestre, também é sinteticamente produzido a partir
da oxidação catalítica da amônia. Portanto, é utilizado em sínteses químicas e ainda como
propelente para foguetes. Entra em equilíbrio químico conforme a equação abaixo.
Qual é o valor da constante, em mol, quando atinge o equilíbrio, se foi usado 0,5 mol/ L de N2O4 (g) em equilíbrio com 2 mols/L de NO2 (g)?
Resolução
3) Sabendo que para o volume de 1 litro
as concentrações de N2O4 e NO2 são respectivamente
0,74mol/L e 0,52 mol/L. Calcule o valor em gramas do
produto da reação no momento em que entra em equilíbrio.
Aproveitando a reação do exercício anterior transformamos a massa do reagente e do produto de mol para gramas.
Quando na reação tiver sido gasto 68,08
g de N2O4 e Produzido 23,92 g de NO2, o produto elevado ao quadrado, dividido pelo
valor do reagente empregado, será o valor do momento que entra em equilíbrio: observe.
1º Transformando mol para grama.
Reagente
1º Transformando mol para grama.
Reagente
2º Utilizando a equação calcula-se o equilíbrio.
Entra em equilíbrio quando atingir 8,40 g.
A constante de equilíbrio dada pela equação e será:
4) Conforme o aspecto quantitativo, num recipiente de 1L a
100ºC, foi utilizado 10 mols de tetróxido de dinitrogênio que produziu 4 mols de dióxido de nitrogênio. Sabendo
que a proporção de produção é de 1 reagente N2O4, para dois de produto NO2
conforme a reação acima. Então 2 mols do reagente produziu 4 mols de produto
quando entrou em equilíbrio, e no final haviam 8 mols de reagentes e 4 mols de
produto. Pergunta-se: qual é a constante de
equilíbrio da reação?
A reação que acontece em um recipiente fechado com a capacidade de um litro, a 100 ºC é mostrada a seguir. A proporção de reagentes e produtos é de 1:2.
A proporção de mols utilizados como reagente = 2 e a quantidade de mols de produtos = 4, a sobra = 4, é a quantidade de mols no equilíbrio.
A reação que acontece em um recipiente fechado com a capacidade de um litro, a 100 ºC é mostrada a seguir. A proporção de reagentes e produtos é de 1:2.
A constante de equilíbrio dada pela equação e será:
5) (Adaptado da Fei - SP) Dada a
reação, com as substâncias nas condições de temperatura e pressão em que se
encontra o sistema:
Escreva a
fórmula para calcular a constante de equilíbrio dessa reação:
No
sistema existem as seguintes concentrações de reagentes e produto nas seguintes
proporções,
SO3 = 0,1 mol/L,
O2 = 1,5 mol/L
SO2 = 1,0 mol/L
Calcule a constante de equilíbrio:
SO3 = 0,1 mol/L,
O2 = 1,5 mol/L
SO2 = 1,0 mol/L
Calcule a constante de equilíbrio:
6) (UFC-CE) considerando um reservatório
mantido à temperatura constante, tem-se estabelecido o equilíbrio químico como na equação:
Sendo que as pressões parciais no equilíbrio
são PCl5 = 0,15 atm, PCl3 =
0,30 atm e PCl2 =
0,10 atm.
Assinale a alternativa correta para o
valor de Kp (em atm) da
reação:
a) 0,05
b) 0,10
c) 0,15
d) 0,20
e) 0,25
Resolução.
7) Observe o gráfico da variação da rapidez da reação até o equilíbrio.
Dos seis itens abaixo, assinale a alternativa incorreta.
a) no início de uma reação, a rapidez do consumo do reagente é rápida.
b) no início rapidez da inversão do produto é muito lenta.
c) no ponto de equilíbrio a reação inversa é mais rápida que a direta.
d) a reação continua se efetuando, vai diminuindo a rapidez da transformação do reagente.
e) a reação continuando vai aumentando a rapidez da reversão do produto.
f) finalmente no equilíbrio a rapidez do reagente e do produto se igualam.
8) Dada a equação química:

Assinale a alternativa em que a equação da constante de equilíbrio na formação da amônia está correta.
Dos seis itens abaixo, assinale a alternativa incorreta.
a) no início de uma reação, a rapidez do consumo do reagente é rápida.
b) no início rapidez da inversão do produto é muito lenta.
c) no ponto de equilíbrio a reação inversa é mais rápida que a direta.
d) a reação continua se efetuando, vai diminuindo a rapidez da transformação do reagente.
e) a reação continuando vai aumentando a rapidez da reversão do produto.
f) finalmente no equilíbrio a rapidez do reagente e do produto se igualam.
8) Dada a equação química:
Assinale a alternativa em que a equação da constante de equilíbrio na formação da amônia está correta.
Questões
1) Sobre equilíbrios químicos podemos dizer que no equilíbrio químico as velocidades das reações:
a) diretas e inversas não são iguais.
b) diretas e inversas são proporcionais.
c) direta e inversas são alteradas
constantemente.
d) indiretas e inversas não
existem.
e) direta e inversas são iguais quando se aplica energia.
2) Num sistema formado por dois reagentes, em plena reação, e em equilíbrio, foi adicionado mais uma certa quantidade de um dos reagentes. O Sistema reagiu bruscamente saindo do equilíbrio o sistema:
a) reage e para bruscamente de funcionar.
b) não reage e continua em equilíbrio normalmente.
c) reage, restabelecendo o equilíbrio novamente.
d) desequilibra e é necessário aumentar a temperatura.
e) reage, neutralizando o reagente adicionado.
3) Uma das condições para haver o equilíbrio químico entre reagentes e produtos é:
a) estar num sistema aberto, onde há troca de matéria com o meio ambiente.
b) os reagentes e produtos estarem na mesma fase.
c) no equilíbrio os reagentes e os produtos reagirem indefinidamente.
d) estar num sistema fechado, onde não há troca de matéria com o meio ambiente.
e) o produto estar concentração elevada, para que acumulado, haja revertibilidade.
4) Numa reação 10 mol de dióxido de nitrogênio gasoso (NO2)(g) reagiu formando 3 mols de tetróxido de dinitrogênio gasoso (N2O4) (g). Pergunta-se qual é a quantidade de reagentes não transformados na reação?
a) 2,0 mols.
a) 3,0 mols.
a) 4,0 mols.
a) 2,5 mols.
a) 4,5 mols.
5) O gás hidrogênio ( H2) reage com o gás iodo (I2), a 400 °C formando o ácido iodídrico, que é utilizado na produção de iodetos orgânicos e inorgânicos e também do ácido acético ou vinagre. A reação da preparação do ácido iodídrico entra em equilíbrio por exemplo, quando 1 mol de H2 (g) reage com 2 mols de I2(g) que aqui está em excesso, produzindo 1,8 mols de HI.
Pergunta-se: quanto de gás hidrogênio e gás iodo sem reagir sobrou na reação, ao entrar em equilíbrio?
a) 0,2 e 0,9
b) 0,1 e 1,1
c) 1 e 2
d) 0,2 e 0,4
e) 0,9 e 1,1
6) Sabendo que para o volume de 1 litro as concentrações de N2O4 e NO2 são respectivamente 0,74mol/L e 0,52 mol/L. Calcule o valor em gramas do produto da reação no momento em que entra em equilíbrio.
a) 2,80 g.
b) 4,20 g.
c) 8,40 g.
d) 10,20 g.
e) 8,10 g.
7) (Adaptado) O tetróxido de dinitrogênio (N2O4) é um gás poluente da atmosfera terrestre, todavia também é sinteticamente produzido a partir da oxidação catalítica da amônia para utilidade humana. Portanto, é utilizado em sínteses químicas e ainda como propelente para foguetes. Entra em equilíbrio químico conforme a equação abaixo. Qual é o valor da constante em mol, quando atinge o equilíbrio?
a) 2,10
b) 5,40
c) 22,00
d) 12,40
e) 8,00
8) Com o aumento da concentração de um reagente na reação, há o deslocamento do equilíbrio químico?
a) não, não ocorre deslocamento nenhum.
b) sim, desloca para esquerda.
c) sim, ocorre deslocamento para a direita.
d) não pode haver deslocamento, porque baixa a pressão da reação.
e) sim, para a direita quando de adiciona um catalisador.
9) Os catalisadores aumentam a velocidade das reações químicas. Ao adicionar um catalisador numa reação, mesmo que este diminua a energia de ativação e aumente a velocidade da reação este:
a) desloca rapidamente o equilíbrio químico.
b) desloca o equilíbrio químico sempre para a esquerda.
c) não desloca o equilíbrio químico, nem altera a velocidade da reção.
d) não interfere no equilíbrio químico, mas proporciona um processo exotérmico.
e) não desloca o equilíbrio químico.
10) Dada a tabela abaixo:

Essa tabela indica que as reações:
a) são de substâncias diferentes com valores diferentes de K.
b) são de substâncias iguais com valores iguais de K.
c) não estão no equilíbrio químico.
c) são de substâncias diferentes com valores iguais de K.
e) de combustão. portanto possuem valores de K muito alto.
Ser Protagonista Química, Ensino Médio 2º Ano 2015, 2017, edições SM. São Paulo 2ª ed. 2013.
Química, João Usberco, Físico Química vol. 2, P. 371.
Química, Ricardo Feltre, Físico-Química, vol.2 6ª ed.São Paulo 2004. Editora Moderna.
Química, João Usberco, Físico Química vol. 2, P. 371.
Química, Ricardo Feltre, Físico-Química, vol.2 6ª ed.São Paulo 2004. Editora Moderna.
Química - Ciências da Natureza, Ensino Médio, 3ª série. Caderno do professor e do aluno volume 1, edição de 2017.
Química vol. 2, João Usberco, Edgard Salvador - Físico Química 13ª ed. 2014 Editora Saraiva.
Equilíbrio Químico - CCEADD PUC-Rio
web.ccead.puc-rio.br/condigital/mvsl/.../conteudo/SL_equilíbrio_quimico.pdf
Martha Reis marques da Fonseca. Química Volume 2, Meio Ambiente, Cidadania, Tecnologia. Editora FTD 1ª ed, São Paulo, 2010.
Equilíbrio Químico - proquímica
proquimica.igm.unicamp.br/introteo.htm
Química vol. 2 Ensino Médio, Eduardo Fleury Mortimer, Andrea Horta Machado, 2ª edição São Paulo, 2014. Editora Scipione.
Química o Homem e a Natureza, vol. 2 Físico Química, Jose Geraldo Covre, Editora FTD, São Paulo 2000.
Química Cidadã vol.2, Pequis - Projeto de Ensino se Química e Sociedade 2ª Ano. Wildson Luis Pereira Dos Santos, Gerson de Souza Mól, Siland Meiry França Dib, Roseli Takako Matsunaga, Sandra Maria de Oliveira Santos, Eliane Nilvana F. de Castro, Gentil de Souza Silva, Silvia Barbosa Farias. Editora AJS, São Paulo 2013, 2ª edição.
Química na Abordagem do Cotidiano. Francisco Miragaia Peruzzo, Eduardo Leite do Canto, Físico-Química, Vol 2, 4ª Edição, Editora Moderna, São Paulo 2010.
Química Na Abordagem Do Cotidiano - Tito e Canto Vol. 2, Editora Moderna, 2ª edição 1999 - São Paulo SP.
Download do arquivo - Projeto Medicina
projeto medicina. com.br/...deslocamento_de_equilíbrio_quimica_exercicios_gabarito...
Victor Nehmi. Química, Volume Único. Editora Ática, São Paulo 1995.