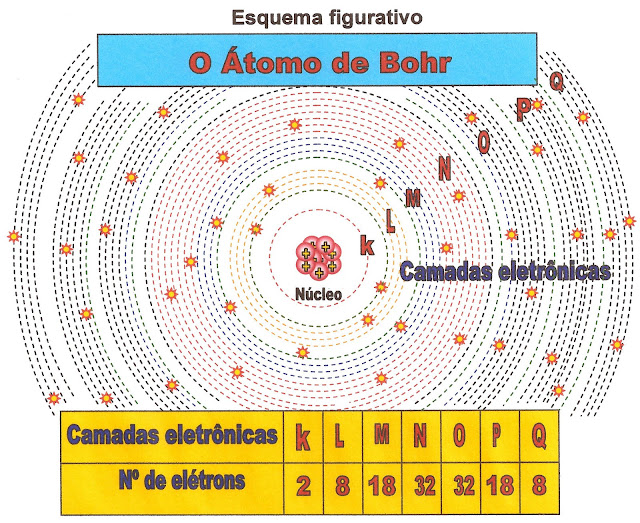
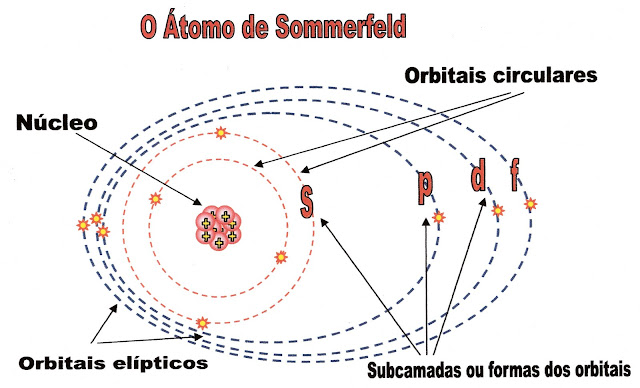
Comentando - Situação de Aprendizagem 2
9ª e 10ª aula 1ª séries - A; B; C; 1TA; 1TB
Interações e Transformações
Transformações químicas
p.6, exerc. 1.
Materiais obtidos diretamente da natureza | Materiais obtidos por transformações quím |
Ouro | Cal |
Madeira | Cimento |
Granito | Ferro para construção |
Mármore | Vidro |
Areia | Plásticos |
P.6, exerc. 2.
A madeira, o granito, o mármore, e até os gases naturais; são obtidos diretamente da natureza já prontos e são utilizados pelo ser humano após passar por uma simples transformação de purificação e já estão prontos para serem utilizáveis. Os materiais como o cimento, o ferro, vidro, plásticos, etc, São obtidos pela transformação de matérias-primas, através de tecnologias com gasto de energia, para que isso aconteça há a necessidade de mão de obra especializada e com custo de produção relativo.
p.7, exerc. 3.
a) O domínio do fogo proporcionava a segurança; afastava as feras predadoras.
b) Era usado na preparação da alimentação; assava as carnes, melhorava o sabor, amaciava as fibras, enfim; cozinhava os alimentos em geral.
c) Proporcionava conforto; aquecia durante o inverno e iluminava o acampamento.
p.7, exerc. 4.
a) A queima do gás de cozinha, GLP ou butano, é uma transformação química. Ao queimar esse gás há a liberação de energia na forma de calor e os produtos finais dessa transformação são o gás carbônico (CO2) e água (H2O).
b) O álcool passado na pele evapora, ao evaporar-se absorve calor. Ao passar para a forma gasosa, mantém a sua estrutura molecular intacta, não forma outra substância, a transformação é apenas física.
p.7. exerc. 5.
a) Não necessariamente! Existem reações que acontecem com uma única substância. Por exemplo: O halogenato de prata, ou cloreto de prata dos filmes fotográficos, não necessita de outras substâncias para reagirem, reagem apenas com a luz.
p.8 exerc. 5.
b) Ao observar a tabela acima, vemos que as três substâncias para reagirem, não precisaram de outras substâncias para se transformarem. Utilizaram apenas energia na forma de calor 1º caso do calcário, a água oxigenada reage com a luminosidade 2º caso, atração do átomo de oxigênio ionizado que se junta à molécula do gás oxigênio para formar a molécula de ozônio, por força atrativa eletromagnética ou por diferenças de potencial de cargas elétricas, como apresenta o 3º caso. Todas as três transformações aconteceram usando apenas energia disponível: térmica, luminosa, e atração por cargas (Íons).
p.11 preencher os espaços em branco da tabela.
Sistema | Estado inicial | Estado final | Evidências de transformações químicas | |
Ácido clorídrico ( HCl), vinagre e carbonato de cálcio | Líquido e sólido branco | Líquido e gasoso formação de gás. | Desprendimento de gas, líquido transparente. | |
Sulfato de cobre e solução de hidróxido de sódio | Líquido azul, mais líquido incolor mais ou menos viscoso | Sólido em forma de gelatina | Formação de sólido gelatinoso hidróxido de cobre. | |
Solução de sulfato de cobre e palha de aço | Líquido azul, esponja de bombril, sólido | sólido | Descoramento da solução azul, formação de um sólido vermelho escuro cor de cobre. | |
Solução de ácido clorídrico e magnésio ou zinco | Líquido viscoso, magnésio pó branco, zinco pó metálico. | Metal oxidado, corroído | Desprendimento de gás e corrosão do metal. | |
Solução de ácido clorídrico e hidróxido de sódio | Líquido viscoso, líquido viscoso | Esquenta, líquido. | Liberação de calor, formação de sal. | |
Gás carbônico e água de cal. | Gás invisível água com sedimento no fundo | Sólido e aquoso. | Formação de um sólido branco. |
Questões para análise do experimento
p. 12, quest. 1
.
Em todas as reações demonstradas na tabela anterior houve a formação de novas substâncias. Houve a modificação na aparência, no sistema, no comportamento das substâncias e no seu estado final.
p.12, quest. 2.
Todas as interações! A solução de ácido clorídrico com o carbonato de cálcio, a solução de sulfato de cobre com o hidróxido de sódio, a solução de sulfato de cobre com a palha de aço, a solução de ácido clorídrico como o magnésio ou zinco, a solução de ácido clorídrico com o hidróxido de sódio, a solução de gás carbônico com água de cal. Todas apresentaram mudanças físico-químicas.
Lição de casa - Comentando a.
p. 12, quest. 1.
a) É uma transformação química a descoloração da roupa, (reação de sustância ácida e a tinta).
b) É transformação física a água líquida que ferve e muda de estado, evapora e continua sendo água na forma gasosa.
c) É transformação física a evaporação da água do mar que apenas evapora e deixa o resíduo de sal sólido.
d) É transformação química, o ferro entra em contato com o oxigênio do ar e forma óxido de ferro (ferrugem).
e) É uma transformação química a fruta que amadurece exibe outra textura e aparência, mudando a cor, o sabor, o cheiro e adoça o paladar.
f) É transformação física, a acetona que gaseifica em contato com o ar, evapora. As moléculas intactas se dispersam, mas continuam sendo da acetona.
p.13, quest. 2.
( F ); ( Q ); ( Q ); ( F ); ( Q ); ( Q ); ( Q ); ( F )
Comentando - o que eu aprendi.
p.13.
Na situação de aprendizagem 2. Transformações químicas; nas aulas as quais participei, aprendi que muitos materiais podem ser obtidos diretamente da natureza, enquanto que outros precisam sofrer transformações de matérias-primas. Aprendi; que as substâncias que formam materiais podem ser transformadas fisicamente e quimicamente. Aprendi que nas transformações químicas os reagentes iniciais ao se transformarem produzem produtos com características de comportamento, aparência, estado finais diferentes. As reações acontecem a partir de uma ativação inicial, como energia na forma de calor, elétrica, luminosa, reações espontânea por atração iônica. Nas transformações físicas não ocorre mudança da estrutura química da substância, mas pode mudar o seu estado físico.
Preenchendo os espaços em branco do caderno do aluno
Situação de Aprendizagem 3
Comentando os Fatores Que Podem Ser Analisados nas Interações e Transformações Químicas.
Exercícios em sala de aula
P.14, exerc. 1. Preenchendo a tabela
classificação | Sinais perceptíveis |
Ñ instantânea | Forma sólido branco |
Instantânea | Ocorre desprendimento de gás |
Instantânea | Chama e calor |
Ñ instantânea | Aparecimento de bolor, cheiro...... |
Instantânea | Aparece ferrugem |
Instantânea | Proteína coagula, aparece cor branca |
p.15 exerc. 2.
No resumo da análise da tabela das transformações químicas que classifica cada reação de acordo com o tempo e com os seus sinais perceptíveis, podemos chegar á conclusão que: numa transformação química, geralmente ocorre sinais perceptíveis na mudança dos reagentes que se transformam nos produtos, por exemplo, na mudança do aspecto das substâncias em transformação, ou na cor, no cheiro, na produção de calor ou esfriamento, na opacidade ou transparência do produto transformado. Quanto ao tempo de ocorrência da reação, há reações que ocorrem em frações de segundos, outras demoram minutos, outras demoram horas, outras ainda demoram dias. Há reações que absorvem energia e há reações que liberam energia, que pode ser na forma de luz, de calor, de radiação etc.
Comentando a Atividade 2 – O fator energia nas interações e transformações químicas
Exercícios em sala de aula
p.15, exerc, 1
.
Na transformação exotérmica, ao acontecer esse tipo de reação, há a liberação de calor para o meio ambiente. Nesse caso ocorre a perda de calor para o meio ambiente. Na reação endotérmica a substância formada ganha energia do meio ambiente na forma de calor. Nesse caso ela retira calor do meio ambiente e armazena no interior de sua massa.
Comentando as Questões para análise do experimento
p.16. Quest. 1
.
Após o aquecimento sim, houve transformação química porque ao aquecer o cristal sólido sulfato de cobre penta hidratado de cor azul, ele se tornou apenas o cristal sólido sulfato de cobre desidratado de cor branca. A estrutura molecular passou de CuSO4 5H2O hidratado, para CuSO4 anidro, mudou a fórmula molecular. Nesse caso ele absorve energia térmica. Ao re-hidratar o sulfato de cobre este ganha massa e libera energia na forma de calor, ao desidratar foi o contrário.
p.17. Quest. 2.
Ao adicionar pequena quantidade de água ao sólido do béquer, a cor do cristal ficou levemente azulada, o que significa que reidratou.
p.17. Quest 3.
Sim! Essa interação com a água promoveu a hidratação da molécula de sulfato sólido de cor branca, que passou de CuSO4, para CuSO4. 5 H2O sólido, de cor azul (mudança da aparência).
p.17. Quest. 4.
O aquecimento do sulfato de cobre em temperatura alta; desidrata, de cor azul passa para a cor branca, o fenômeno é endotérmico. Na hidratação observa-se uma visível mudança de aspecto, o cristal branco fica azul, o fenômeno é exotérmico; há a liberação de calor.
p. 17. Quest. 5.
a) Estas representações do quadro dessa página significam as equações químicas das reações. Na primeira reação houve desidratação do CuSO4. 5. H2O, na segunda reação é o processo de re-hidratação do sulfato de cobre CuSO4.
p. 17. Quest. 5.
b) Substituindo os nomes das substâncias pelas fórmulas químicas nós temos.
Comentando a Revertibilidade das interações e transformações químicas
Exercícios em sala de aula
p.18. Quest. 1.
Na transformação revertível os reagentes iniciais reagem formando produtos, até certa quantidade ou ponto de equilíbrio ou saturação da reação. Ao atingir esse ponto os produtos formados começam a voltar a transformar em reagentes.
p. 18. Quest. 2.
Transformação irrevertível é a reação direta em que os reagentes formam produtos que permanecem estáveis até o consumo total dos reagentes, que não voltam à etapa inicial.
p.18. Quest. 3.
Preencher os espaços em branco da tabela.
Fenômeno | Classificação |
Irrevertível | |
Irrevertível | |
Revertível | |
Irrevertível | |
Irrevertível |
Comentando a Lição de casa
p.18. Quest. 1.
Três exemplos de reações instantâneas.
Queima da pólvora ou a explosão da mesma, a queima do gás metano, a reação de uma solução de ácido clorídrico e hidróxido de sódio.
Três exemplos de reações não instantâneas.
Enferrujamento do ferro pelo contado deste com o oxigênio do ar, e amadurecimento da fruta banana, apodrecimento de madeira exposta ao tempo.
p.19. Quest. 2.
Preencher os espaços em branco da tabela.
Etapa | Formas de energia envolvidas | Classificação | É uma transformação química? |
Térmica | Exotérmica | Sim | |
Térmica | Endotérmica | Não | |
Térmica | Endotérmica | Não | |
Térmica | Endotérmica | Sim | |
Térmica | Endotérmica | Sim |
p.19. Quest. 3.
Reações revertíveis são aquelas em que os reagentes iniciais se transformam em produtos e os produtos ao atingirem certa quantidade de síntese, ou equilíbrio; retornam ao reagente inicial. As reações irrevertíveis são as ditas diretas, os reagentes ao se transformarem em produtos não retornam aos reagentes iniciais. As reações revertíveis são a secagem do calcário e o aquecimento do calcário. As reações irrevertíveis são; a queima do carvão, a decomposição do calcário e a produção de ferro.
Comentando o que aprendi
p.20. Resp.
Neste capítulo nas aulas que participei, aprendi que os fatores como o tempo, a temperatura, a aparência; são sinais que podem ser analisados nas reações e que podem distinguir as interações e transformações químicas uma das outras. Além disso, aprendi que certas reações acontecem instantaneamente e outras acontecem á longo prazo. Aprendi que as transformações químicas podem absorver ou liberar energia do meio ambiente na forma de calor. No procedimento experimental aprendi que uma substância sólida cristalizada pode conter água residual, e essa água pode ser retirada dessa estrutura e mudar a aparência física, tornando-a completamente desidratada, mudando sutilmente seu aspecto visual e a sua conformação estrutural molecular, portanto, percebi que isso foi o indicativo de que ocorreu uma transformação química. Aprendi que as reações químicas podem ser escritas numa linguagem representativa quimicamente própria através de fórmulas. Aprendi que as transformações químicas, umas podem ser irrevertíveis, e outras são revertíveis.
Comentando a Situação de Aprendizagem 4
A Produção do Álcool Combustível e do Ferro
Fermentação do álcool etanol
Buscar definição de: aciaria e escória.
p.22. Quest. 1
O texto trata de dois importantes produtos produzidos no Brasil, economicamente importantes e amplamente usados, o combustível álcool e o metal ferro.
 |
| A fig. mostra álcool absoluto usado em laboratóriosde análises |
p.22. Quest. 2.
Brasil é um dos maiores produtores de álcool, que é um produto orgânico extraído da plantação de canaviais, é produzido por transformação do açúcar da garapa da cana, que é fermentado, depois destilado e finalmente passando por desidratação para se tornar anidro. É um combustível de uso doméstico em geral. O ferro provém de minérios de ferro como a hematita, magnetita, siderita, pirita, que são transformados em altos fornos, á altas temperaturas, no metal ferro puro.