Tiol ou Tióis
O grupo Tiol é formado pelo radical -SH, substituindo o oxigênio da hidroxila de um grupo dos álcoois pelo enxofre, geralmente eles tem o pH muito ácido, como por exemplo o butanotiol que tem o pKa em torno de 10,5. Portanto os tióis possuem -SH como seu grupo funcional, sendo um composto sulfurado o enxofre, que tem uma característica própria de ser dos malcheirosos, como por exemplo das substâncias 3-metilbutanotiol, que são expelidas pelas glândulas dos gambás, ou outra substância o etanotiol, utilizado misturado ao gás para dar mal odor ao gás de cozinha de botijão e pode evitar vazamento pelo odor. Outra importância dos compostos desse grupo é que o radical tiol -SH que é muito abundante no meio intracelular e assim sendo esse radical se faz um importante redutor antioxidante que está presente no aminoácido cisteina em grande volume no meio intracelular.
Exemplos de Tióis
Metanotiol
Etanotiol
Propanotiona - Uma tiocetona
Butano-1-tiol
Penicililamina
4-MMP ou 4-mercapto-4-metilpentan-2-ona - Aroma de cássia
Benzenotiol
Furano-2- ilmetanotiol ou 2-furfuriltiol
Um dos componentes do aroma do café.
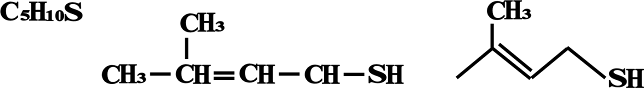
3-metil-2-buteno-1-tiol
A três estruturas abaixo representa o mesmo produto 3-metil-2-buteno-1-tiol com as fórmulas molecular, estrutural plana e em barras.
Cisteina
Outro exemplo de substância com o grupo tiol é a cisteina aminoácido da proteina estrutural formadora da queratina responsável pela resistencia do tecido, promovida pelas grande quantidade de ligações de enxofre - enxofre (S-S) das cadeias polipeptidicas da proteína formando uma rede fibrosa resistente, cuja função é possibilitar a elasticidade da pele, cabelos e unhas e por fim, formando uma barreira mecânica de impermeabilidade à água.
Preparação de Tióis
Tiol preparado a partir de álcool com sulfeto de hidrogênio.
Etanol sulfeto de etanotiol água
hidrogênio
Preparação de Etanotiol a partir do brometo de etila com hidrogenossulfeto de sódio
brometo de etila hidrogenossulfeto de etanotiol brometo
sódio de sódio
Oxidação e Redução de um Tiol Oxidação de um tiol
Oxidação do etanotiol em dissulfeto de etila
etanotiol iodo dissulfeto de dietila iodeto de
hidrogênio
Uso Dos Tióis
Uso do butanotiol
O butanotiol é um composto da família das mercaptana, que pode ser usado industrialmente misturado na composição do gás de cozinha de botijão. Sua propriedade é proporcionar mal odor ao gás inodoro sem alterar a sua qualidade, se por acaso houver vazamento no botijão possa ser dectado pelo olfato ou mal cheiro que ele proporciona. Outro cuidado que devemos ter com relação ao butanotios é ao ser inalado ele pode causar fraqueza, confusão mental, tosse, tontura, sonolência, náusea, vômitos e falta de ar.
Benzenotiol
O benzenotiol é utilizado na indústria farmacêutica na preparação do medicamento timerosal substância antiséptica do merthiolate agente anti infeccioso.
Uso da penicilamina
A penicilamina é utilizada como medicamento antirreumático no combate da inflamação crônica especialmente do sistema imunológico, como no caso da doença de Wilson, doença hepatolenticular que é hereditária autossômica recessiva em que ocorre o acúmulo tóxico de cobre em tecidos do cérebro e do fígado. No caso da cistinúria causada pelos cristais do aminoácido cistina que pode induzir a formação de cristais de cistina na urina. Nesse caso, a penicilamina liga-se a cistina tornando a mais solúvel, impedindo assim a formação de cálculo renal sendo posteriormente excretada pela urina.
Além do mais, a penicilamina é utilizada como medicamento antirreumático, combatendo a inflamação crônica do sistema imunológico, como por exemplo; a artrite reumatóide que causa dor e inchaço das articulações das mãos e dos pés.
Tiol Na cerveja
O 4 MMP ou 4-mercapto-4-metilpentan-2-ona, um tiól, cujo aroma é o de cássia ou seja, de canela, além de apresentar ainda outras fragrâncias acentuando aromas diferentes de flores silvestres e arbustos na cerveja.
Questões
1) É um composto da família das mercaptana, que pode ser usado industrialmente misturado na composição do gás de cozinha de botijão. Sua propriedade é proporcionar mal odor ao gás inodoro sem alterar a sua qualidade, se por acaso houver vazamento no botijão possa ser detectado pelo olfato ou mal cheiro que ele proporciona.
a) benzenotiol
b) etanotiol
c) 3-metil-2-buteno-1-tiol
d) Butano-1-tiol
2) É um aminoácido da proteina estrutural formadora da queratina responsável pela resistencia do tecido, promovida pelas grande quantidade de ligações de enxofre - enxofre (S-S) das cadeias polipeptidicas da proteína formando uma rede fibrosa resistente, cuja função é possibilitar a elasticidade da pele, cabelos e unhas e por fim, formando uma barreira mecânica de impermeabilidade à água:
a) cisteína.
b) cistina.
c) metionina.
d) lisina.
e) alanina.
3) Observe a reação de preparação de um tiol pela equação abaixo.
Os reagentes dessa reação são:
a) o gás metano e o ácido sulfídrico.
b) do etanol com sulfeto de hidrogênio.
c) acetona e dióxido de enxofre.
d) brometo de etila com iodo.
e) metil-benzeno e etanol.
4) As duas estruturas abaixo representam a fórmula de uma única substância que é:
a) o ácido carboxílico.
b) o etanotiol.
c) a cisteina.
d) a glicina.
e) a propanotiona.