A Distribuição Eletrônica
Distribuição Eletrônica em Camadas e Subcamadas
Distribuição Eletrônica em Camadas e Subcamadas
A distribuição eletrônica significa distribuir os elétrons de um átomo em camadas e subcamadas conforme as regras de Bohr e Sommerfeld.
É importante termos o conhecimento pelo fato de descobrirmos através dessa distribuição, os elétrons da camada de valência ou da subcamada que farão a ligação de um átomo com outro, para formar as moléculas ou as substâncias. Portanto revela o numero de elétrons que farão as ligações entre os átomos além de dar uma ideia do número de elétrons dos ânions e cátions e da carga positiva ou negativa desses íons.
O Diagrama de Linus Pauling
Linus Carl Pauling - químico quântico e bioquímico, nascido em 1901 e falecido em 1994, nos Estados Unidos.
Linus Carl Pauling - químico quântico e bioquímico, nascido em 1901 e falecido em 1994, nos Estados Unidos.
O diagrama de Linus Carl Pauling, é o modelo de distribuição eletrônica para qualquer átomo da tabela periódica.
Para a distribuição dos elétrons de qualquer átomo, deve-se obedecer as regras do diagrama.
Os níveis eletrônicos são sete, K, L, M, N, O, P, Q, para os átomos naturais que são 92.
Nível 1 ou camada K, comporta no máximo 2 elétrons.
Nível 2 ou camada L, comporta no máximo 8 elétrons.
Nível 3 ou camada M, comporta no máximo 18 elétrons.
Nível 4 ou camada N, comporta no máximo 32 elétrons.
Nível 5 ou camada O, comporta no máximo 32 elétrons.
Nível 6 ou camada P, comporta no máximo 18 elétrons.
Nível 7 ou camada Q, comporta no máximo 2 ou 8 elétrons.
Os subníveis eletrônicos são quatro, s, p, d, f. para os átomos naturais.
O subnível s comporta no máximo 2 elétrons.
O subnível p comporta no máximo 8 elétrons.
O subnível d comporta no máximo 10 elétrons.
O subnível f comporta no máximo 14 elétrons.
Diagrama de Linus Pauling
Esquema da distribuição das camadas e subcamadas eletrônicas de Linus Pauling.
A representação das camadas, número de orbitais e subníveis pode ser esquematizado dessa forma:
Distribuição Eletrônica
A distribuição eletrônica é feita com o número de elétrons de cada um dos elementos químicos. O número de elétrons é o mesmo que o do número atômico de cada átomo e esse número de elétrons vai aumentando conforme a sequência dos elementos dispostos na tabela periódica.
As Formas dos Orbitais dos Subníveis “s” e “p”
Os elétrons pertencentes ao subnível “s” formam orbitais esféricos.
Segundo Rutherford-Bohr os elétrons se dispõem em torno do núcleo do átomo em orbitais circulares. Cada orbital comporta no máximo 2 elétrons. Os orbitais “s” tem a forma circular enquanto que os orbitais híbridos “p” tem a forma bilobulado ou em hélice e foi idealizado por Linus Carl Pauling.
O átomo de hidrogênio só possui um elétron, portanto, a sua distribuição fica contida na primeira camada, no orbital esférico (ou circular) do subnível “s”.
Hélio (He)
O átomo de hélio possui um orbital e dois elétrons e a sua distribuição eletrônica está localizada na primeira camada K, no orbital esférico (ou circular) do subnível “s”.
O elemento químico hélio forma o gás hélio. O gás hélio é um gás que pertence ao conjunto dos gases nobres. Esse gás é formado por um único átomo isolado, não há ligações entre os átomos de hélio para a formação desse gás, por isso é chamado de monoatômico. O gás hélio em si é uma substância simples, também não se combina com átomos ou elementos químicos diferentes.
Na condição de elemento químico, a representação estrutural de sua massa é formada por dois prótons (carga positiva) e dois nêutrons (sem carga elétrica), e possui também dois elétrons girando no orbital distante do núcleo, que balanceiam a carga positiva dos prótons. No entanto a massa dos dois elétrons não é considerada, por ser proporcionalmente desprezível.
Lítio (Li)
O átomo de lítio possui três elétrons e a sua distribuição está localizada na primeira camada a K, e segunda camada a L, nos orbitais esféricos ou circulares do subnível “1s” e “2s”.
O átomo de lítio possui três elétrons e a sua distribuição está localizada na primeira camada a K, e segunda camada a L, nos orbitais esféricos ou circulares do subnível “1s” e “2s”.
Berílio (Be)
O átomo de berílio possui quatro elétrons e a sua distribuição está localizada na primeira camada a K, e segunda camada a L, nos orbitais esféricos do subnível “1s” e “2s”.
O átomo de berílio possui quatro elétrons e a sua distribuição está localizada na primeira camada a K, e segunda camada a L, nos orbitais esféricos do subnível “1s” e “2s”.
As Formas dos Subníveis s e p
Boro (B)
O átomo de boro possui cinco elétrons e a sua distribuição está localizada na primeira camada a K, e segunda camada a L, possui dois orbitais esféricos ou circulares no subnível “1s” e “2s” e um elétron no orbital p1 do subnível “p”.
O átomo de boro possui cinco elétrons e a sua distribuição está localizada na primeira camada a K, e segunda camada a L, possui dois orbitais esféricos ou circulares no subnível “1s” e “2s” e um elétron no orbital p1 do subnível “p”.
 |
| Observe que no orbital "p" puro, o elétron passa atrás e na frente do núcleo relativamente equidistante como nas extremidades da hélice simbólica . |
Carbono (C)
O átomo de carbono possui seis elétrons e a sua distribuição está localizada na primeira camada a K, e segunda camada a L, possui dois orbitais esféricos no subnível “1s” e “2s” e dois elétrons nos orbitais p1 e p2 do subnível “p”.
O átomo de carbono possui seis elétrons e a sua distribuição está localizada na primeira camada a K, e segunda camada a L, possui dois orbitais esféricos no subnível “1s” e “2s” e dois elétrons nos orbitais p1 e p2 do subnível “p”.
Nitrogênio (N)
O átomo de nitrogênio possui sete elétrons, a sua distribuição está localizada na primeira camada a K, e segunda camada a L, possui dois orbitais esféricos com dois elétrons cada, no sub-nível “1s” e “2s” e três elétrons distribuidos nos orbitais p1, p2 e p3 do sub-nível “p”.
O átomo de nitrogênio possui sete elétrons, a sua distribuição está localizada na primeira camada a K, e segunda camada a L, possui dois orbitais esféricos com dois elétrons cada, no sub-nível “1s” e “2s” e três elétrons distribuidos nos orbitais p1, p2 e p3 do sub-nível “p”.
Oxigênio
O átomo de oxigênio possui oito elétrons e a sua distribuição está localizada na primeira camada a K, e segunda camada a L, possui dois orbitais esféricos com dois elétrons cada, no sub-nível “1s” e “2s” e quatro elétrons distribuídos nos orbitais p1, p2 e p3 no sub-nível “p”. O orbital p1 possui dois elétrons e está completo e os p2 e p3 estão incompletos.
Potássio
A distribuição eletrônica do átomo de potássio fica:
Iodo
Mercúrio
O átomo de iodo possui 53 elétrons e está localizado na coluna 7A, termina com 7 elétrons na camada
de valência, no orbital s e p. Portanto, o iodo é monovalente.
Mercúrio
A distribuição eletrônica do átomo de mercúrio que possui o número atômico 80 e o mesmo número de elétrons, tem portanto, todos os níveis eletrônicos preenchidos.
A distribuição dos elétrons do átomo de mercúrio ficaria assim:
1s2, 2s2, 2p6, 3s2, 3p6, 3d10, 4s2, 4p6, 4d10, 4f14, 5s2, 5p6, 5d10, 6s2.
Metais de Transição
A Distribuição Eletrônica dos Elementos Químicos de Transição.
A distribuição eletrônica dos elementos
de transição segue a sequência de quatro períodos e dez colunas, que toma a seguinte configuração representada na tabela
a seguir.
| O esquema aqui representa como termina a distribuição eletrônica, para os átomos de transição da tabela periódica. |
Inclui-se também os lantanídios e os actinídios que são elementos químicos de transição interna.
Escândio
Vejamos exemplos: o escândio é o primeiro dos elementos de transição interna. A sua distribuição eletrônica termina no subnível 4s2 e 3d1. A sua distribuição eletrônica fica da seguinte maneira:
Vejamos exemplos: o escândio é o primeiro dos elementos de transição interna. A sua distribuição eletrônica termina no subnível 4s2 e 3d1. A sua distribuição eletrônica fica da seguinte maneira:
21Sc45 1s2
2s2 2p6
3s2 3p6 3d1
4s2
Titânio
A seguir ao escândio vem o titânio. A sua distribuição eletrônica termina no subnível 4s2 e 3d2. cuja distribuição eletrônica pode ser representada:
A seguir ao escândio vem o titânio. A sua distribuição eletrônica termina no subnível 4s2 e 3d2. cuja distribuição eletrônica pode ser representada:
22Ti47,9 1s2
2s2 2p6
3s2 3p6 3d2
4s2
Ferro
O ferro pertence aos metais de transição.
Fazendo a distribuição eletrônica do átomo de ferro no estado fundamental.
Note que o elemento químico ferro possui dois locais de ligação 3d6 e 4s2
Fazendo
a distribuição eletrônica do átomo de ferro como íon cátion bivalente:
Último Orbital de um Átomo
Para entendermos a ionização de um elemento químico, temos que ter também a ideia da localização do último orbital eletrônico do átomo.
O orbital mais interno é aquele que está mais próximo do núcleo, os orbitais intermediários estão mais distanciados do núcleo e o orbital mais distante do núcleo é o mais externo onde ocorre a ionização. A energia empregada para arrancar esse elétron é bem menor que a energia para arrancar um elétron próximo do núcleo.
Temos também que entendermos que os elementos químicos variam em tamanho e massa variando também no número de orbitais que possuem.
Átomos pequenos tem um ou poucos orbitais, átomos medianos possuem um número médio de orbitais, átomos grandes possuem muitos orbitais.
Ionização de um Elemento Químico
Ionização de um elemento químico é a transferência de um elétron de seu orbital mais distante do núcleo, para outro átomo que recebe esse elétron.
Quando acontece ionização?
Um bom exemplo de ionização é quando você coloca ácido em água A água "quebra" as moléculas do ácido gerando ânions e cátions. Veja exemplo:
Ácido clorídrico reagindo com água libera o cátion hidrogênio que perde um elétron e o ânion cloro que recebe o elétron do hidrogênio.
Ferro Cátion Bivalente
Ao se transformar no íon cátion bivalente Fe2+, o ferro se ioniza perdendo dois elétrons da última camada da distribuição eletrônica.
Cobre
A distribuição eletrônica do átomo de cobre que possui o número atômico 29 e o mesmo número de elétrons, tem portanto, todos os níveis eletrônicos preenchidos com exceção do nível 4 subnível 1, que tem apenas um elétron.
Estrôncio
Estrôncio elemento químico de transição
O cobre pertence aos elementos químicos de transição.
A distribuição dos elétrons do átomo de cobre fica assim:
1s2, 2s2, 2p6, 3s2, 3p6, 3d10, 4s1.
Valencia do Cobre Mono ou Bivalente
O cobre pode ser monovalente Cu1+ ou bivalente Cu 2+
Estrôncio elemento químico de transição
Quando o elemento químico termina com 4 elétrons na última camada da distribuição eletrônica, como no caso do chumbo, ele Tanto pode perder 4 elétrons como receber 4 elétrons. Nesse caso ele é um elemento químico tetravalente.
Urânio
O átomo de urânio está localizado no período dos elementos de transição interna, Actinídios, termina no subnivel 7s2 e
5f4 mais
energéticos.
A Abstração
Talvez no momento pensemos que filosofar é estar à margem do concreto imediatista. No entanto, ainda convém acreditar que há hipóteses e teorias que por mais que pareçam abstratas ou lúdicas, nos levam á novas buscas e procura pela verdade e nos abrem portas para novas idéias e descobertas. Se levarmos em conta a conversa entre Linus Pauling e a resposta á Heisenberg acerca da teoria apoiada em experiências, sobre as órbitas dos elétrons e de seus saltos longos, ou do tipo de salto, disse Pauling, que teria reservas em admitir tais afirmações, porém refletindo: qual das alternativas ele deveria escolher?
A Regra de Hund
Os subníveis eletrônicos só existem na teoria, as camadas eletrônicas na verdade não necessitam desses subníveis, para a distribuição de seus elétrons em orbitais ao redor do núcleo. No entanto para se ter uma explicação racional sobre o comportamento dos orbitais e seus elétrons, é que se leva em consideração uma regra que se pareça mais plausível até que se confirme essa idéia ou se prove o contrário.
A Regra de Friedrich Hermann Hund físico alemão, diz que na distribuição eletrônica devemos preencher primeiramente todos os orbitais de um sub-nível com apenas um elétron, para depois em seguida preencher os mesmos orbitais com um segundo elétron.
No entanto seguindo essa regra percebemos que há sub-níveis que permanecem incompletos, como no caso da distribuição eletrônica do urânio, que no subnível “f” da quinta camada ele tem apenas três elétrons para três orbitais, os outros orbitais desse sub-nível permanecem vazios ou inexistentes. No nível seis, o subnível “d” possui apenas um elétron permanecendo os outros vazios ou inexistentes.
No esquema abaixo representamos simbolicamente um orbital com seus dois elétrons e o giro de cada um deles em torno de si mesmo.
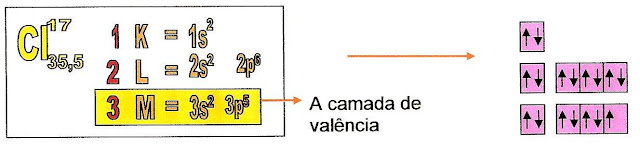
Observe o esquema abaixo da distribuição eletrônica do átomo de cloro no estado fundamental, nota-se que no subnível "p" uma "casinha" não está completamente preenchida com o número total de elétrons, pois o cloro possui na sua camada de valência sete elétrons. Cada elétron no orbital é representado por seu spin positivo ou negativo.
A distribuição eletrônica do átomo de cálcio no estado fundamental, ou seja; o isótopo de cálcio estável de massa 40 e número atômico 20.
A distribuição eletrônica do átomo de ferro no estado fundamental. Nota-se que que o subnível "d" do terceiro nível, os seus cinco orbitais comportam dez elétrons no entanto está preenchido com apenas 6 elétrons porque dois elétrons passam a formar a camada de valência no nível quatro.
A distribuição eletrônica do átomo de urânio no estado fundamental.
Orbitais - Elétrons e Campos Magnéticos
Os elétrons de orbitais diferentes ao girarem em suas órbitas e em torno de sí mesmos, formam campos magnéticos de atração ou de repulsão. Segundo teorias, esses campos magnéticos de atração ou de repulsão é que manteriam a conformação da estrutura atômica e esses mesmos elétrons “presos” orbitando o átomo sem deixar seu “caminho” e sem se aproximarem demais um dos outros.
Campo Eletromagnético de Atração
Giros dos Elétrons
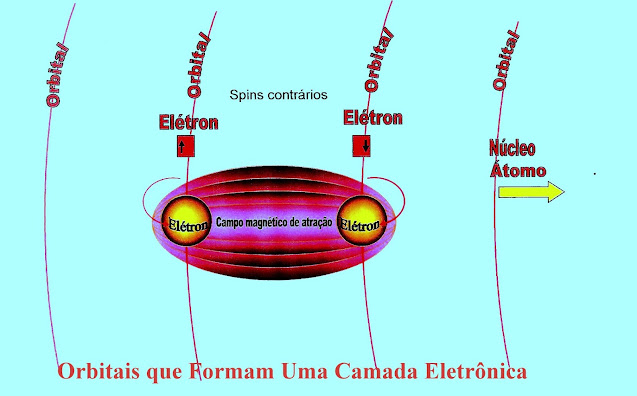
Os elétrons giram em torno do núcleo do átomo.Mas os elétrons ainda possuem giros (spins) em torno de si mesmos, que geram campos de atração ou a dispersão desses mesmos elétrons.
O giro dos elétrons de spins contrários formam campo magnético de atração mantendo os dois orbitais unidos.
O giro dos elétrons de spins contrários formam campo magnético de atração mantendo os dois orbitais unidos.
O giro dos Elétrons de spins de sentidos contrários cria um campo de atração entre os orbitais do mesmo átomo mantendo-os unidos.
Teoricamente, os campos magnéticos de atração, formados pelos elétrons girando nos seus respectivos orbitais, formariam as camadas eletrônicas e manteriam os orbitais próximos unidos nas camadas de orbitais que são atraídas pelo núcleo do átomo.
A figura logo a seguir mostra dois elétrons de giros contrários em orbitais separados, formando campos magnéticos de atração desses orbitais.
Campo Eletromagnético de Repulsão
O giro dos elétrons de spins no mesmo sentido cria o campo magnético de repulsão dos orbitais.
A Distribuição Eletrônica de um Íon
Quando um átomo está no estado neutro, as suas cargas de prótons e elétrons estão equilibradas. Então, por exemplo; se um átomo tem seis prótons e também tem seis elétrons, as cargas positivas e negativas estão em equilíbrio, nesse caso ele é um átomo que está no estado neutro. Se o átomo perdeu ou ganhou elétrons, o número entre seus prótons e elétrons está em desequilíbrio, portanto esse átomo está no estado ionizado. Os íons podem ser chamados de cátions quando o número de prótons do seu núcleo superar o de elétrons que giram nos seus orbitais distantes do núcleo, e podem ser chamados de ânions quando o número de elétrons superar o de prótons.
Distribuição Eletrônica do Átomo de Sódio
Distribuição Eletrônica do Átomo de Sódio
Questões
1) A distribuição eletrônica significa, distribuir os:
a) prótons de um átomo em camadas horizontais e subcamadas verticais.
b) nêutrons de um átomo em linhas horizontais.
c) elétrons de um átomo em camadas horizontais e subcamadas verticais.
d) átomos de uma molécula em camadas e subcamadas.
e) átomos em camadas e subcamadas de valência.
2) Os níveis eletrônicos são:
a) seis, K, L, M, N, O, P, para os átomos naturais que são 118.
b) sete, K, L, M, N, O, P, Q, para os átomos naturais que são 92.
c) quatro, S, P, D, F, para os átomos naturais que são 82.
d) oito, J, K, L, M, N, O, P, Q, para os átomos naturais que são 92.
e) sete, Na, K, Mg, N, O, P, , para os átomos naturais que são 92.
3) Assinale apenas a alternativa incorreta. Os subníveis eletrônicos para os átomos naturais são:
a) são quatro, o subnível r comporta no máximo 1 elétron.
b) são quatro, o subnível s comporta no máximo 2 elétrons.
c) são quatro, o subnível p comporta no máximo 8 elétrons.
d) são quatro, o subnível d comporta no máximo 10 elétrons.
e) são quatro, o subnível f comporta no máximo 14 elétrons.
4) O átomo de urânio é um átomo grande, possui 92 elétrons distribuídos em orbitais. É o maior átomo natural existente. O número de orbitais desse átomo é:
a) 42 sendo as camadas k, L, M, N, N, O, P, Q, com 1, 4, 9, 16, 16, 9, 1, orbitais respectivamente.
b) 44 sendo as camadas J, K, L, M, N, O, P, Q, com 2, 4, 9, 16, 16, 9, 8, orbitais respectivamente.
c) 46 sendo as camadas k, L, M, N, N, O, P, com 3, 4, 9, 16, 16, 9, 1, orbitais respectivamente.
d) 48 sendo as camadas k, L, M, N, N, O, P, Q, com 3, 6, 8, 10, 20, 5, 2, orbitais respectivamente.
e) 46 sendo as camadas k, L, M, N, N, O, P, Q, com 1, 4, 9, 16, 16, 9, 1, orbitais respectivamente.
5) O átomo de hidrogênio só possui um elétron, portanto, a sua distribuição fica contida na primeira camada, no orbital circular:
a) do subnível “p”.
b) do subnível “d”.
c) do subnível “f”.
d) do subnível “s”.
e) do subnível “k”.
6) O átomo de boro possui cinco elétrons e a sua distribuição está localizada na primeira camada a K, e segunda camada a L, possui dois orbitais esféricos ou circulares no subnível:
a) “2s2” e “3s2” e um elétron no orbital p6 do subnível “p”.com o orbital em forma de hélice.
b) “1s2” e “2s2” e um elétron no orbital p1 do subnível “p” com o orbital em forma de hélice.
c) “1s2”, “2s2” e no 3s2 e um elétron no orbital p1 do subnível “p” de orbital circular.
d) “1s2” “2s2” e no 2p e um elétron no orbital p1 do subnível “p” de orbital circular.
e) “1s” e “2s” e seis elétrons no orbital p do subnível “p” de orbital circular.
7) O átomo de iodo possui 53 elétrons e está localizado na coluna 7A, então, termina com 7 elétrons na camada de valência, no orbital s e p. Portanto, o iodo é monovalente.
Assinale a alternativa em que está a distribuição correta dos elétrons do iodo.
a) 2s2; 2p2; 2p6; 3s2; 3p6; 3d10; 4s2; 4p6; 4d10; 5s2; 5p5
b) 2s2; 2s2; 2p6; 3s2; 3p6; 3d10; 4s2; 4p6; 4d10; 5s2; 5p7 c) a) 1s2; 2s2; 2p6; 3s2; 3p6; 3d10; 4s2; 4p6; 4d10; 5s2; 5p6; 6p2
d) a) 1s2; 2s2; 2p6; 3s2; 3p6; 3d10; 4s2; 4p6; 4d10; 5s2; 5p6; 5d10; 6p2
e) 1s2; 2s2; 2p6; 3s2; 3p6; 3d10; 4s2; 4p6; 4d10; 5s2; 5p5
8) A distribuição eletrônica do átomo de mercúrio (Hg) que possui o número atômico 80 e o mesmo número de elétrons, tem portanto todos os níveis eletrônicos preenchidos.
A distribuição correta para os elétrons do átomo de mercúrio é:
a) 1s2, 2s2, 2p6, 3p6, 3d10, 4s2, 4p6, 4d10, 4f14, 5s2, 5p6, 5d10, 6s2.
b) 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 4p6, 4d10, 4f14, 5s2, 5p6, 5d10, 6s2.
c) 1s2, 2s2, 2p6, 3s2, 3p6, 3d10, 4s2, 4p6, 4d10, 4f14, 5s2, 5p6, 5d10, 6s2.
d) 2s2, 2s6, 3p6, 3s2, 3p6, 3d10, 4s2, 4p6, 4d10, 4f14, 5s2, 5p6, 6p10, 6d2.
e) 2s2, 2p6, 3s2, 3p6, 3d10, 4s2, 4p6, 4d10, 4f14, 5s2, 5p6, 5d10, 6s2.
9) De acordo com as teorias sobre o átomo, orbital mais interno é aquele que está mais próximo do núcleo, os orbitais intermediários estão um pouco mais distanciados do núcleo enquanto que:
a) o elétron mais distante do orbital é o mais interno onde ocorre a ionização do átomo.
b) o orbital mais distante do núcleo é o mais externo onde ocorre a ionização do átomo.
c) a camada intermediária do núcleo é a mais interna onde ocorre a ionização do elétron.
d) o orbital mais distante do núcleo é o mais interno onde ocorre a formação do átomo.
e) a camada mais perto do núcleo é o mais externo onde ocorre a degradação do átomo.
10) Quando um átomo ou elemento químico transfere um elétron de seu orbital mais distante do núcleo, para outro átomo que recebe esse elétron, esse fenômeno é chamado de:
a) catalização.
b) polarização.
c) potenciação.
d) Ionização.
e) eletrostática.
11) Um bom exemplo de quando acontece ionização gerando ânions e cátions é quando se
a) transforma ácido em água. A água "quebra" as moléculas do ácido.
b) retira ácido da água. A água "isola" as moléculas do ácido.
c) coloca ácido em soda caustica. A soda "une" as moléculas do ácido.
d) coloca ácido em água. A água "desintegra " as moléculas do ácido.
e) coloca ácido em água. A água "quebra" as moléculas do ácido.
12) O elemento químico (átomo) do ferro pode sofrer ionização em uma, duas, até três vezes, perdendo um, dois, ou três elétrons das últimas camadas da distribuição eletrônica.
Ao sofrer ionização duas vezes ele pode se transformar:
a) no íon ânion bivalente Fe2+
b) no íon cátion trivalente Fe2-
c) no íon cátion bivalente Fe2+
d) no íon ânion monovalente Fe2-
e) no íon cátion bivalente F2+
13) Os elétrons giram em torno do núcleo do átomo. Mas os elétrons ainda possuem giros (spins) em torno de si mesmos, que geram campos de atração ou a dispersão desses mesmos elétrons.
Esses giros formam campos magnéticos que determinam o arranjo ou "colam" os orbitais no átomo.
O giro dos elétrons de spins contrários formam:
a) orbitais de contração mantendo os dois orbitais distantes.
b) campo magnético de atração, mantendo os dois orbitais próximos unidos.
c) campo magnético de repulsão mantendo os dois orbitais dispersos.
d) campo eletrostático de atração mantendo os dois elétrons unidos.
e) campo elétrico de repulsão mantendo os dois orbitais unidos.
Texto em construção....................