Definição
Os Exemplos
A Utilidade dos Alcanos
A Hibridação sp dos Carbonos nos Alcanos
A Nomenclatura dos Alcanos
A Isomeria com os Alcanos.
Dipolo Induzido-Dipolo Induzido
Reações dos Alcanos
Porque a Organização em Grupos Orgânicos
Para uma melhor compreensão por parte dos alunos e leigos no assunto, tenta-se colocar as substâncias com os mesmos radicais funcionais, ou aqueles pertencentes a um grupo de substâncias com características específicas todas juntas num mesmo grupo. No entanto é difícil falar de um grupo funcional específico, já que as substâncias em grande parte, muitas vezes, são formadas por radicais pertencentes a mais de um grupo ou então são derivadas ou são transformadas nas reações em substâncias pertencentes a outros grupos funcionais. Contudo a tentativa de se colocar em um grupo separado cada assunto abordado é apenas uma maneira de se fazer mais compreensível.
Os alcanos são substâncias formadas por hidrocarbonetos de cadeias carbônicas saturadas lineares ou acíclicas, ou ainda cíclicas com ou sem ramificação. Os hidrocarbonetos são moléculas constituídas apenas pelos elementos químicos carbono e hidrogênio.
Geralmente são insolúveis em água, um exemplo bem comum é o da gasolina em especial o octano, que não é polar em relação á água, ou os óleos tipo diesel que são solúveis apenas em solventes como o thinner, ou se dissolvem propriamente na gasolina ou querosene.
Á temperatura ambiente, a 25ºC, os alcanos de carbonos C1 a C4 são gasosos, os com o número de carbonos de C5 a C17 são líquidos e os de cadeia carbônica acima de 17 são sólidos.
Os Alcanos e a Combustão
Os alcanos geralmente são ótimos combustíveis, queimam com facilidade, a combustão feita com suficiente gás oxigênio (O2) é total, a sua combustão completa tem como resultado a produção de gás carbônico (CO2) e água (H2O).
Exemplos de Alcanos
O gás etano é o hidrocarboneto em segundo lugar em número de carbonos dos alcanos, é representado por dois carbonos na cadeia principal.


O gás propano é o hidrocarboneto em terceiro lugar em número de carbonos dos alcanos, é representado por três carbonos na cadeia principal.


O gás butano é o hidrocarboneto em quarto lugar em número de carbonos dos alcanos, é representado por quatro carbonos na cadeia principal.

Os Elementos Químicos da Molécula do Gás Butano e Polaridade

Os Elementos Químicos da Molécula do Gás Butano e Polaridade
Se fizermos uma análise da estrutura da molécula do gás butano, podemos ver que a eletronegatividade do hidrogênio, H = 2,2 e do
carbono, C = 2,55, essas duas
eletronegatividades, favorecem a configuração estrutural da molécula do gás
butano, que é formado por ligações moleculares covalentes.
Com a eletronegatividade dos elementos químicos formadores tão próximas subentende-se que a molécula seja
apolar ou com uma polaridade muito fraca.
No entanto se fizermos comparativamente
um esquema das moléculas desse gás no estado gasoso, perceberíamos que as moléculas representativamente estariam afastadas
e a força de atração entre elas inexistem. Porém, no estado líquido podemos entender
que as moléculas, estariam mais próximas uma das outras, por uma força
de atração maior que no estado gasoso. Nota-se então o aumento da polaridade entre as moléculas com a formação do dipolo-dipolo-induzido.
O pentano é o hidrocarboneto em quinto lugar em número de carbonos dos alcanos, é representado por cinco carbonos na cadeia principal.
Metil pentano ou Isobutano
Metil pentano ou Isobutano
O hexano se encontra no estado líquido, é o hidrocarboneto em sexto lugar em número de carbonos dos alcanos, é representado por seis carbonos na cadeia principal.


O heptano se encontra no estado líquido, é o hidrocarboneto em sétimo lugar em número de carbonos dos alcanos, é representado por sete carbonos na cadeia principal.
O octano se encontra no estado líquido é o hidrocarboneto em oitavo lugar em número de carbonos dos alcanos, é representado por oito carbonos na cadeia principal.
Isooctano ou 2,2,4 - trimetil-pentano Gasolina octanada.
Isooctano ou 2,2,4 - trimetil-pentano Gasolina octanada.
Querosene
O querosene é uma fração do petróleo que por craqueamento se obtém frações da gasolina, possuem cadeias carbônicas de 11 a 14 carbonos. No entanto o querosene na forma utilizável não tem formula definida porque é uma mistura de hidrocarbonetos alifáticos naftalênicos e aromáticos.
Óleo Diesel
Óleo diesel líquido de cadeias com 15 a 18 carbonos.
Óleos Lubrificantes
Óleos Lubrificantes possuem, cadeias carbônicas de 16 a 24 carbonos.
Parafinas
As parafinas são derivadas do petróleo, possuem cadeias carbônicas de 38 a 50 carbonos e pode ser representada conforme a figura abaixo.
A Formação, Obtenção e Uso Dos Hidrocarbonetos Alcanos
O querosene é uma fração do petróleo que por craqueamento se obtém frações da gasolina, possuem cadeias carbônicas de 11 a 14 carbonos. No entanto o querosene na forma utilizável não tem formula definida porque é uma mistura de hidrocarbonetos alifáticos naftalênicos e aromáticos.
Óleo Diesel
Óleo diesel líquido de cadeias com 15 a 18 carbonos.
Óleos Lubrificantes
Óleos Lubrificantes possuem, cadeias carbônicas de 16 a 24 carbonos.
Parafinas
As parafinas são derivadas do petróleo, possuem cadeias carbônicas de 38 a 50 carbonos e pode ser representada conforme a figura abaixo.
A Formação, Obtenção e Uso Dos Hidrocarbonetos Alcanos
A Obtenção do Gás Metano
O gás metano como gás natural é extraído de jazidas ou depósitos geológicos subterrâneos, misturado ou não com petróleo. Pode também ser extraído de madeira por destilação seca com calor não muito elevado, por volta de 80 ºC.
O gás metano dos pântanos é formado pela fermentação anaeróbica da celulose, através de microrganismos decompositores em anaerobiose.
O gás metano pode ser obtido do carvão mineral hulha, por processo de destilação seca na ausência de oxigênio, numa temperatura entre 600 e 1000 ºC.
O gás metano também é formado nos intestino dos animais, inclusive do ser humano, pela Escherichia coli, uma bactéria produtora de gases que habita normalmente nosso intestino. Também é produzido na digestão da biomassa pelos animais e herbívoros em geral, especialmente pelos ruminantes no rúmen, ou seja; a primeira parte de seu estômago que se divide em três, onde há bactérias e protozoários decompositores realizando a pré-digestão da celulose.
O gás metano é encontrado no fundo dos oceanos, preso sob camadas de sedimentos e pressão da água. Pesquisas atuais realizadas levam a acreditar que, se esse gás do fundo do oceano for liberado para a atmosfera contribuirá em grande parte para a elevação da temperatura atmosférica do planeta. Materiais orgânicos como a palha de arroz, depois de fermentada, também é utilizada para gerar energia elétrica em motores á combustão.
O gás metano de lixo. Os lixões ou aterros de lixo, geram grande quantidade de metano através da biodegradação por microrganismos, especialmente pela E. coli em condições anaeróbica.
O gás metano de vinhaça (que é o resíduo de sujeiras descartado na produção de açúcar ou álcool) das usinas é aproveitado para gerar energia para a própria usina, no entanto; o processo é caro e desestimula os produtores.
O gás metano pode ser produzido por biodigestores os quais utilizam os dejetos animais ou outros tipos de
O gás metano de esgotos, e de animais domésticos como porcos (suínos), vacas (bovinos), suas fezes podem gerar biogás, que é um composto formado de grande parte de metano, gás carbônico, dióxido de enxofre, água, etc e ser aproveitado para gerar energia de consumo.
A Utilidade do Gás Metano (CH4)
O gás metano está sendo muito utilizado como gás canalizado de cozinha, após sair da jazida é passado por um processo de limpeza no qual se retira o excesso de água, gás carbônico, dióxido de enxofre e partículas de sujeiras que possa conter.
É usado para produzir energia elétrica através dos motores de combustão.
É usado como gás combustível para veículos automotores.
Obtenção do Gás Etano
O gás etano pode ser extraído juntamente com o metano das jazidas minerais, é também obtido a partir da destilação do petróleo. Outro meio de obtenção é por um processo químico denominado eletrólise de Kolbe, a partir do ácido acético, (processo que não compensa devido á disponibilidade na natureza). É também pouco compensatório a sua separação por estar associado à presença do metano. O seu ponto de fusão é de -181.76ºC e o de ebulição de -89ºC.
O Uso do Gás Etano
O uso do gás etano está na indústria, que o transforma em gás etileno, normalmente também é usado para combustão e produção de energia na forma de calor, juntamente com o gás metano.
Obtenção do Gás Propano
O gás propano pode ser extraído juntamente com o metano das jazidas minerais, pode ser também extraído do petróleo juntamente com o gás butano.
O Uso do Gás Propano
O gás propano é usado como combustível para gerar energia térmica, produz uma chama límpida, por isso é usado nos laboratórios de pesquisa, em aparelhos de espectrofotometria de chama, é mais energético que o butano.
A indústria química o utiliza para a síntese do propeno na preparação de borrachas e também como gás refrigerante (com a sigla R290) que é a tara para agir como gás refrigerador numa pressão de 290 libras .
É usado como gás propulsor.
Obtenção do Gás Butano
Obtenção do Gás Butano
O gás butano é extraído por aquecimento lento do petróleo por destilação, craqueamento ou pirólise. É um gás incolor, inodoro e altamente inflamável.
Uso do Gás Butano
O gás butano é usado juntamente com o gás propano como gás engarrafado de cozinha e por vias de tubulações até as residências. É utilizado também como gás de isqueiro e como propelentes de aerosois.
Obtenção do Pentano
O pentano é derivado do petróleo, ao ser destilado, se encontra no estado líquido, é muito volátil porque a sua massa e número de carbonos está muito próximo dos alcanos gasosos.
Uso do Pentano
O pentano é usado como solvente em laboratórios, e em cromatografia líquida. Está adicionado à gasolina em pequena porcentagem.
Atualmente indústrias de geladeiras tem utilizado também o pentano como gás de refrigeração, em substituição ao CFC, muito prejudicial ao meio ambiente.
A geladeira da foto ao lado utiliza o pentano C como gás de refrigeração.
Para saber o tipo de gás de refrigeração da sua geladeira, basta observar na sua parte traseira, há uma etiqueta identificando o gás utilizado.
A geladeira da foto ao lado utiliza o pentano C como gás de refrigeração.
Para saber o tipo de gás de refrigeração da sua geladeira, basta observar na sua parte traseira, há uma etiqueta identificando o gás utilizado.
Uso do Metil Pentano ou Isobutano
Obtenção do Hexano
O hexano é extraído por destilação do óleo crú ou do petróleo.
O Isopentano ou metil pentano tem aplicação como solvente, também é utilizado na fabricação de
cosméticos como gel de barbear, sabonetes e até cremes dentais. Também pode ser aplicado na produção de
isolante térmico.
Obtenção do Hexano
O hexano é extraído por destilação do óleo crú ou do petróleo.
Uso do Hexano
É um dos constituintes da gasolina.
Tem o seu uso industrial na formulação da cola de sapato, na indústria textil, na extração de óleo da água, é usado em laboratórios e na preparação de organolitiuns que consiste na ligação entre compostos orgânicos com o lítio. Tem a aplicação na indústria farmacêutica e é adicionado á gasolina para baratear.
Obtenção do Heptano
O heptano é extraído por destilação do petróleo.
É a gasolina ruim explode antes do tempo não queimando totalmente, não funciona plenamente. O rendimento do motor, especialmente dos veículos automotores é baixo, é colocado numa proporção aproximada de 40 % misturado ao isooctano para que melhore a qualidade do combustível.
Uso do Heptano
Uso do Heptano
É usado adicionada á gasolina, é facilmente inflamável, também é irritante para a pele. Na água é muito tóxico para os organismos aquáticos, podendo causar efeitos nefastos a longo prazo nesse ambiente. Nocivo para os seres humanos: pode causar danos nos pulmões se ingerido, pode provocar sonolência e vertigens, por inalação dos vapores. É usado em laboratório nas microemulções, componente do surfactante aerosol de base gel, é solvente orgânico básico da gelatina e serve na síntese de vários ésteres.
Obtenção do Octano
O octano é extraído por destilação do petróleo.
Uso do Octano
Faz parte da composição da maior parte da gasolina boa, usada em veículos automotores.
Uso do Isooctano
É adicionado á gasolina boa que apresenta octanagem 60%, porque é adicionada na proporção de 60%. É um antidetonante da mesma, melhora a qualidade de queima e o rendimento do motor.
A figura ao lado mostra o carro sendo abastecido com isooctano - gasolina de boa qualidade.
A Gasolina Para Climas Quentes e Climas Frios
Obtenção do Querosene
A figura ao lado mostra o carro sendo abastecido com isooctano - gasolina de boa qualidade.
A Gasolina Para Climas Quentes e Climas Frios
As gasolinas para climas quentes possuem em sua composição, menores teores de substâncias cujas moléculas são menores em peso molecular porque possuem maior facilidade de evaporação devido ao calor dos meses mais quentes do ano. Essas moléculas que estão presentes na gasolina são o butano e o pentano. Nos países de climas frios essas substâncias que vaporizam facilmente são mantidas na composição da gasolina.
Obtenção do Querosene
Querosene é extraído por destilação fracionada do petróleo, em temperatura entre 150°C e 239°C .
Uso do Querosene
O querosene é usado em iluminação, como solvente e combustível para aviação.
Obtenção do Óleo Diesel
Óleo diesel é o combustível mais usado no Brasil, provém da destilação fracionada do petróleo. A sua cadeia carbônica contém de 12 a 22 átomos. A temperatura de destilação está entre 260°C e 340°C , a sua estrutura molecular e composição como substância demonstra ser formado principalmente por hidrocarbonetos (carbono e hidrogênio) e em baixas concentrações por enxofre, nitrogênio e oxigênio.
Uso do Óleo Diesel
É utilizado para gerar energia. Tem seu uso em caminhões, ônibus, veículos automotores a diesel de pequeno porte, tratores e motores de combustão a óleo diesel em geral.
Observação: há vários tipos de óleo diesel.
A Parafina – Obtenção
Extraída do petróleo, a parafina é formada por vários compostos, sendo a menor partícula
de sua composição o metano, além disso possui moléculas como o octano. As cadeias carbônicas se apresentam com número acima de 20 carbonos a sua fórmula molecular é C36H74, é inodora de cor branca, translúcida, insípida, solúvel em benzeno ou álcool quente, é insolúvel em água. Contém substâncias cancerígenas e o seu limite no ar sem provocar poluição é de 2 mg/m³.
de sua composição o metano, além disso possui moléculas como o octano. As cadeias carbônicas se apresentam com número acima de 20 carbonos a sua fórmula molecular é C36H74, é inodora de cor branca, translúcida, insípida, solúvel em benzeno ou álcool quente, é insolúvel em água. Contém substâncias cancerígenas e o seu limite no ar sem provocar poluição é de 2 mg/m³.
Uso da Parafina
É usado como combustível (velas), lubrificante, isolante elétrico, base para goma de mascar, serve também para a fabricação de cosméticos, sachês perfumados de parafina.
Uso do Éter do Petróleo
O éter do petróleo é obtido pela destilação do petróleo, não tem nada a ver com o éter comum, é uma mistura de pentano e hexano. A benzina, benzeno ou éter do petróleo é utilizado nas tinturarias, na lavagem de roupa a seco e na remoção de adesivos.
As Ligações Entre os Átomos de Carbono Para a Formação Dos Alcanos
A Hibridação “sp”
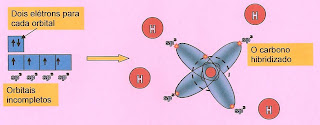
O que é hibridizar o carbono? O carbono no estado fundamental, isto é; como ele está na tabela periódica não se liga a outro átomo para formar o alcano. É necessário ocorrer transformações na estrutura do átomo criando novo orbital e transformando os orbitais “s” e “p” em orbitais híbridos “sp” para que ocorra as ligações químicas. Vejamos essas transformações teoricamente.
O carbono no estado fundamental
Começamos pela distribuição eletrônica do átomo de carbono.
 |
| Após serem distribuidos, observa-se na camada de valência do carbono quatro elétrons que formarão os orbitais híbridos. |
Distribuindo os elétrons segundo a regra de Hund fica:
 |
| Observe que há dois elétrons em dois orbitais "p" puro que estão semipreenchidos e outro orbital vazio que está recebendo o elétron vindo do orbital "s". |
Notamos que com a regra de Hund podemos esquematizar os dois orbitais “s” puro completos e os dois orbitais “p” puro incompletos. A configuração é mostrada abaixo.
O Carbono Ativado
A ativação do carbono consiste na saída de um elétron do subnivel 2s para a formação do orbital “p3” no subnivel “p”.
O Carbono Hibridizado
O átomo de carbono hibridizado toma a conformação apresentada abaixo. O orbital do subnivel “s” esférico se alonga transformando em “sp” e o orbital “p” longo e puro em forma de hélice, retrai se transformando em “sp” híbrido. Assim se formam os quatro orbitais “sp” híbrido.
 |
| Um orbital "s" se alongou e os três orbitais "p" encolheram formando a estrutura apresentada na figura. |
A Formação da Molécula do Metano
Com o esquema apresentado fica fácil entender a formação do gás metano. Aproximam-se quatro átomos de hidrogênio com seus elétrons e preenchem os orbitais “sp” semi preenchidos do carbono.
 |
| Note no esquema a aproximação de quatro átomos de hidrogênios atraidos pelo átomo de carbono hibridizado. |
Outras formas de representação da molécula do gás metano.
A Formação da Molécula do Etano
A Formação da Molécula do Etano
Na formação do etano as ligações entre os carbonos, da mesma forma que do metano são simples sp, sp.
A formação da molécula se completa quando os orbitais “s” do hidrogênio se junta com os orbitais “sp” formando a ligação de orbitais híbridos “sp” e com orbitais puros “s”.
Outras formas de representação da molécula do etano.
A Formação da molécula do Propano.
O propano é formado da mesma forma que o metano e o etano, os carbonos são ligados por ligações sp – sp, e o carbono ligado com o hidrogênio forma a ligação s - sp.
A Nomenclatura dos Alcanos
Metano - molécula com 1 carbono, recebe o prefixo “met” mais a terminação “ano” - metano.

Etano - molécula com 2 carbonos, recebe o prefixo (“et”) mais a terminação "ano” - etano.
A Nomenclatura dos Alcanos de Cadeia Ramificada
Antes de passarmos para a nomenclatura, devemos ter alguma noção sobre o que são radicais alquilas – R.
Radicais alquilas são monovalentes que corresponde a retirada de um átomo de hidrogênio (H) do carbono (C) saturado.
Os seus nomes dependem do número de carbonos de sua cadeia principal.
Os nomes desses radicais dependem do número de carbonos de sua cadeia principal. Do mesmo modo que os alcanos não ramificados iniciamos a sua nomeação da seguinte forma: 1 C met, 2 C et, 3 C prop, 4 C but.
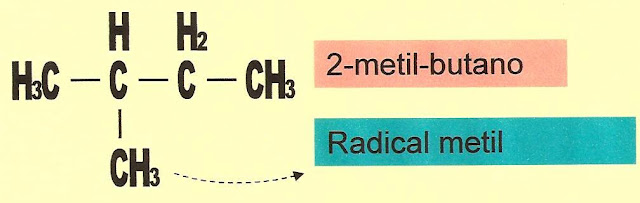
A Formação do Radical metil
Ponto ou Traço Num Radical
Ponto ou traço num radical significa a existência de um elétron livre, ou a valência livre é o local onde ele irá se inserir na cadeia carbônica principal da molécula a ser formada.
Observando o esquema abaixo vemos que sai um átomo de hidrogênio da molécula do metano, formando-se assim o radical metil.
A Formação do Radical Etil
Sai um átomo de hidrogênio de uma das extremidades da molécula do etano (C2H6).
A Formação do Radical Propil
Sai um átomo de hidrogênio de uma das extremidades da molécula do propano.
 |
| Radical propil |
A Formação do Radical Butil
Sai um átomo de hidrogênio de uma das extremidades da molécula do butano.

Radicais Isopropil, isobutil
Os Radicais ou grupos Isopropil, isobutil, (nomenclatura antiga mas ainda considerada pela IUPAC).
A Sequência da Nomenclatura dos Alcanos de Cadeia Ramificada
Primeiro passo: achar a cadeia carbônica principal que é a mais longa.
Segundo passo: numeram-se os carbonos da cadeia carbônica principal começando do lado que o radical está mais próximo da extremidade, na cadeia mais longa.
A nomenclatura de uma molécula é iniciada com os radicais de cadeias de carbonos que possuem os nomes de sequência do alfabeto mais próximo do inicio. Exemplo: etil, começa com “e” é mais próximo do inicio do alfabeto, que o metil que começa com “m”.
De acordo com o que aprendemos podemos chamar a molécula apresentada abaixo de:
2-metil-propano
2-methylpropane
O isobutano é usado na fabricação de poliolefinas e na expansão de polímeros. É usado como propelente em spray,é alternativo dos CFC (cloro flúor carbono) muito prejudicial ao meio ambiente. O isobutano é utilizado também como refrigerante em sistema hermético de refrigeração (R 600 a).
2,2-dimetil-propano
2,2-dimetil-propano
2-metil-butano ou Isopentano
3-etil-4metil-heptano
A mesma molécula apresentada acima, considerando as posições dos radicais na cadeia carbônica vista "de um ângulo" diferente.
3-etil-4metil-heptano
3-etil-4metil-heptano
3-etil-4,4,5-metil-octano
5-etil-3,6-metil-nonano
Forças Intermoleculares Dos Alcanos
Dipolo Induzido-Dipolo Induzido
Dipolo induzido-dipolo induzido é o
deslocamento da nuvem de elétrons da molécula apolar quando se aproxima de
outra molécula apolar. Geralmente os hidrocarbonetos são as substâncias que apresentam esse tipo de ligação
intermolecular.
Podemos observar que mesmo nas moléculas apolares como do metano (CH4) do etano (C2H6) e outros gases desse grupo, existe uma força atrativa entre as suas moléculas, quando essas substâncias estão no estado líquido ou sólido. Essa força atrativa entre as moléculas acontece quando uma molécula se aproxima da outra e induz a deformação de um dos lados. Por causa dessa deformação da nuvem eletrônica que se desloca para um dos lados é que ocorre a indução da formação da polaridade.
Gás Propano
As moléculas do propano no estado gasoso estão afastadas e não há formação do dipolo induzido ou forças de London que são ligações muito fracas. As moléculas no estado líquido ou sólido se aproximam e ocorre a formação do dipolo induzido.
Molécula do gás propano apolar
Podemos observar que mesmo nas moléculas apolares como do metano (CH4) do etano (C2H6) e outros gases desse grupo, existe uma força atrativa entre as suas moléculas, quando essas substâncias estão no estado líquido ou sólido. Essa força atrativa entre as moléculas acontece quando uma molécula se aproxima da outra e induz a deformação de um dos lados. Por causa dessa deformação da nuvem eletrônica que se desloca para um dos lados é que ocorre a indução da formação da polaridade.
Gás Propano
As moléculas do propano no estado gasoso estão afastadas e não há formação do dipolo induzido ou forças de London que são ligações muito fracas. As moléculas no estado líquido ou sólido se aproximam e ocorre a formação do dipolo induzido.
Molécula do gás propano apolar
Formação de Dipolo - Dipolo Induzido no Gás Propano
A temperatura baixa ou a pressão pode determinar a formação das ligações intermoleculares dipolo induzido, nos gases como nesse caso.
Esquema figurativo de moléculas do gás propano quando induzidas à formação dos dipolos.
Esquema aumentado das moléculas do propano sendo atraídas pelos dipolos induzidos.
Isomeria que Acontece Com os Alcanos
Isomeria é um fenômeno que acontece com os alcanos. São substâncias diferentes que apresentam a mesma massa molecular, o mesmo número de átomos, no entanto possuem diferentes ligações ou diferentes disposições espaciais desses átomos.
Um alcano somente é isômero de outro alcano. Exemplo:
Isômeros de Cadeia
Acontece como o butano e o isobutano (metil-propano), as configurações de suas respectivas cadeias são diferentes.
Outra isomeria de cadeia possível é a do pentano com o metil-butano.
O metil butano é utilizado na preparação de herbicida, fertilizante e inseticida. A sua configuração como isômeros é a seguinte:
Outro tipo de isômeros de cadeia é o do pentano com o metil-butano e o dimetil-propano.
Outro exemplo de isômero de cadeia são o buteno-2 ou but-2-eno e o ciclobutano.
Reações dos Alcanos
O processo de combustão do gás metano (CH4) se dá pela combinação com duas moléculas de gás oxigênio resultando uma molécula de gás carbônico e duas moléculas de água.
Reação de Hidrogenação
Catalítica
O eteno ou etileno, ao ser adicionado gás
hidrogênio, com a temperatura exata, tendo o níquel como catalisador, rompe uma da dupla ligação, no caso a ligação pi, e sofre
adição de hidrogênios transformando-se em etano.
Processo de Sabatier-Senderens. Serve para produção de margarinas com óleos vegetais. No entanto esse processo é mais caro e dispendioso do que obter o alcano já pronto do petróleo gás natural.
Reação de Hidrogenação
Catalítica do Ciclopropano
O ciclopropano mais gás hidrogênio com o catalisador de preferência o níquel, mais a temperatura, rompe a ligação cíclica adicionando dois hidrogênios na estrutura e se transforma em propano substância gasosa.
Reação de Halogenação
Na halogenação do metano, ocorre a retirada dos hidrogênios da molécula e a inclusão de outro radical, no caso o cloro, para formar o halogênio.
Foram retirados todos os átomos de hidrogênios do metano, para inserir o cloro e formar o tetracloreto de carbono e ácido clorídrico.
Reação de Craqueamento Catalítico
É uma reação química do processo de quebra de moléculas de certos óleos com 16 carbonos, derivados da destilação do petróleo, em 2 moléculas com 8 carbonos cada uma obtendo assim o octano que é gasolina utilizada nos veículos automotores. Esse processo é catalítico porque se usa catalisador e é chamado de craqueamento ou pirólise pois o aquecimento chega a 500ºC.
Alcanos
Nome do Aluno......................................................................................Nº..........Ano.........
Exercícios Simplificados
1) São substâncias formadas por hidrocarbonetos de cadeias carbônicas saturadas lineares ou acíclicas, ou ainda cíclicas com ou sem ramificação os.
a) alcinos
b) alcanos
c) alcenos
d) alcadienos
2) Os hidrocarbonetos, nesse caso os alcanos; são moléculas constituídas apenas pelos elementos químicos carbono e hidrogênio.
a) carbono e oxigênio
b) carbono e hidrogênio
c) carbono e nitrogênio
d) Hidrogênio e nitrogênio
3) Das moléculas dos alcanos apresentadas abaixo, a substância que está no estado físico gasoso, na
temperatura ambiente 25 ºC, é somente:
a) C8H18
b) C7H16
c) C36H74
d) C4H10
e) C13H28
4) As moléculas dos hidrocarbonetos apresentam na sua estrutura molecular apenas os elementos químicos.
a) cobre, carbono, carboxila.
b) carvão hidrogeno e oxigênio.
c) carbono e hidrogênio.
d) carbono, enxofre e hidrogênio.
e) nitrogênio, carvão, hidrogênio.
5) Um bom exemplo de alcanos de cadeia de um único carbono é o:
a) gás etano b) o pentano, c) gás butano d) gás propano e) gás metano
6)
Pode-se extrair da madeira, por destilação seca á temperatura não muito
elevada, o gás:
a) butano.
b) sulfídrico.
c) óxido nitroso.
d) carbônico.
e) metano.
7) O gás metano é geralmente extraído de jazidas
minerais, juntamente com o petróleo ou não. No entanto, há um mineral do qual
podemos extrair uma taxa de 30% desse gás. Esse mineral é:
a) a siderita.
b) a bauxita.
c) o carvão hulha.
d) a autunita.
e) a cuprita.
8) Os biodigestores produzem o biogás, gás obtido de
lixo, de resíduos agrícolas, da vinhaça, de esgotos domésticos, de dejetos de
animais, da casca de arroz, etc. Esse gás
combustível é uma mistura gasosa
com 50 a 70% do gás.
a) monóxido de carbono.
b) dióxido de carbono.
c) argônio.
d) metano.
e) hélio.
9) O gás butano (C4H10) é o gás
engarrafado de cozinha, que pode ser obtido:
a) de jazidas minerais, juntamente como o petróleo.
b) por craqueamento ou pirólise e destilação do petróleo.
c) por síntese biológica a partir de material orgânico.
d) pela síntese industrial.
e) de biodigestores a partir do lixo.
10) Se a gasolina que nós usamos nos veículos automotores no dia-a-dia, apresentar octanagem
60% de rendimento, isso significa:
a) que é colocado 60% de gasolina isooctano,
juntamente com 50% da gasolina n-heptano ,
hexano, isopentano, compostos de enxofre e outros componentes.
b) que possui 40% de
gasolina isooctano, juntamente com 40%
da gasolina n-heptano, hexano, isopentano, polímera e outros componentes.
c) que é colocado 100%
de gasolina isooctano, juntamente com 30%
da gasolina n-heptano , hexano, isopentano polímera e
outros componentes.
d) que possui 60% de
gasolina isooctano, juntamente com 40%
da gasolina n-heptano, hexano, isopentano, polímera, compostos de enxofre,
e outros componentes.
e) que possui 60% de gasolina polímera, juntamente com
60% da gasolina
n-heptano, hexano, isopentano, polímera e outros componentes.
11) A estrutura que representa o alcano ramificado cíclico 1,1-dimetil-ciclo-butano é: Assinale apenas a alternativa correta.
a) b) c) d) e)
a) b) c) d) e)
12) A reação de hidrogenação catalítica mantém o número de carbonos na cadeia, mas adiciona hidrogênio na estrutura molecular. Conforme a afirmativa dada, podemos dizer que ocorreu reação de hidrogenação catalítica apenas na alternativa:
a) b) c) d) e)
a) b) c) d) e)
13) Podemos definir dipolo-dipolo induzido nas moléculas do propano como:
a) dipolo-dipolo induzido ou o deslocamento da nuvem de átomos da molécula apolar quando se aproxima de outra molécula polar.
b) dipolo induzido-dipolo induzido é o deslocamento da nuvem de moléculas polares quando se aproxima de outra molécula apolar.
c) dipolo-dipolo induzido é a deformação da nuvem eletrônica que se desloca para um dos lados da molécula, é quando ocorre a indução da formação da polaridade na molécula apolar.
d) dipolo-dipolo induzido é a formação da nuvem eletrônica que se desloca para os dois lados da molécula, é quando ocorre a indução da formação da polaridade.