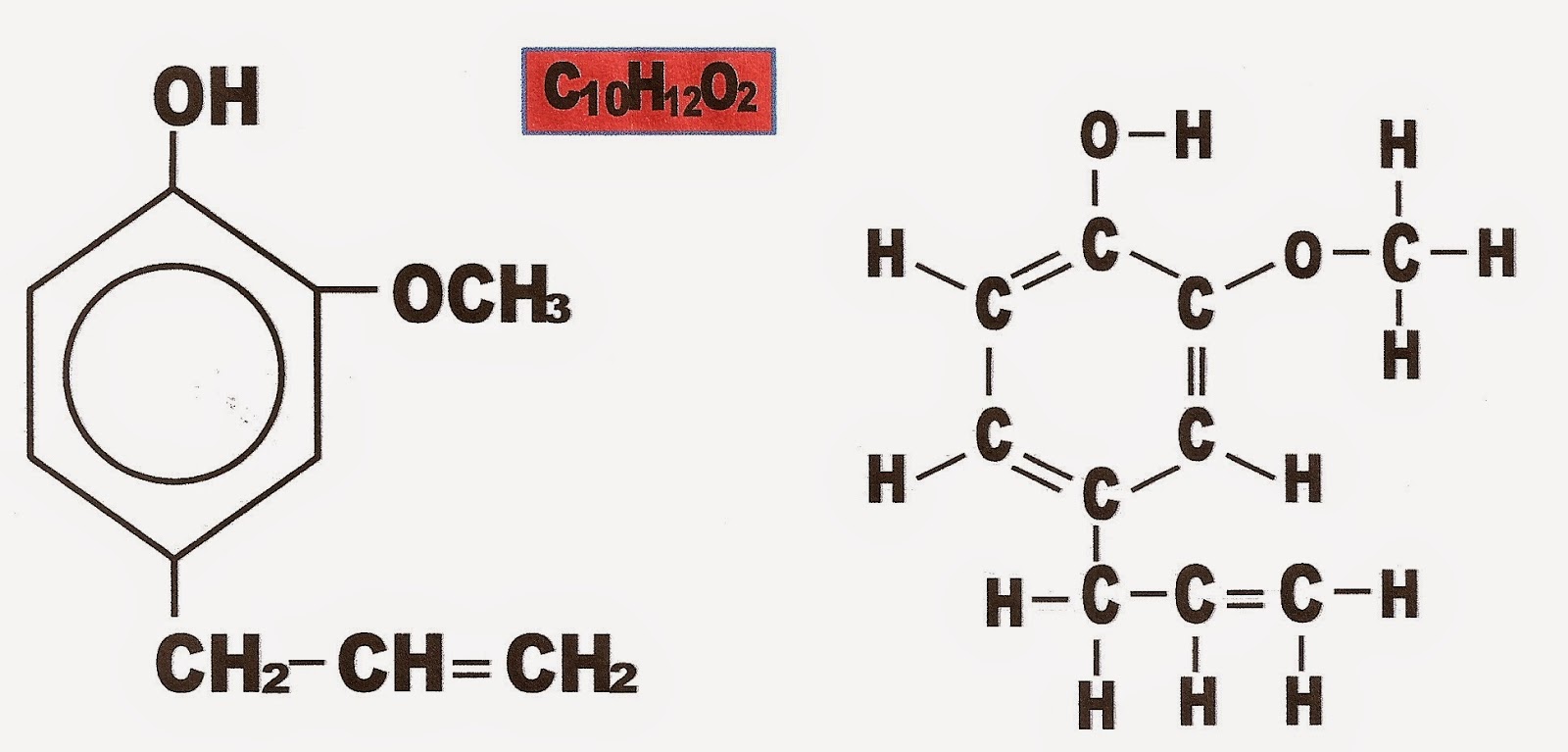
Aminas
Conteúdo
Definição.
Exemplos de Aminas.
Cassificação Das Aminas de Acordo Com a Substituição de Um Hidrogênio do Nitrogênio.
Aminas - Substâncias de Caráter Anfótero.
Presença das Aminas
Nomenclatura Das Aminas.
A Utilização das Aminas
Reações Das Aminas.
Exercícios.
Bibliografia.
Definição
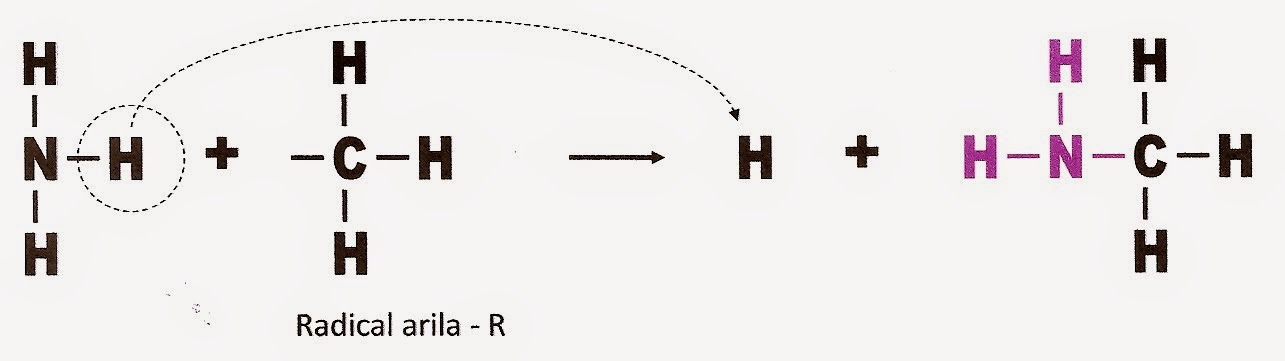
Aminas possuem o radical funcional NH2. As aminas são
compostos orgânicos nitrogenados derivados da amônia ou amoníaco (NH3). Para se
transformar em amina, um hidrogênio da amônia é trocado por um radical arila ou alquila. Veja
exemplo
.
A formação de uma amina a partir do radical arila, R.
A formação de uma amina a partir de um radical alquila (Ar aromático)

Presença das Aminas
As aminas estão presentes nos aminoácidos essenciais para o organismo humano, como a lisina, leucina, isoleucina, metionina, fenilalanina, treonina, triptofano, valina e histidina, e nos aminoácidos não essenciais como a glutamina , glicina, prolina, tirosina, cisteína, serina e aspártico. Se encontra também nos alimentos, em nutrientes como nas diversas carnes bovina, suína, caprina, de aves em geral, nos peixes, nos grãos em geral, nos cereais, frutas. Estão presentes em drogas farmacológicas, como acetaminofen, diabinese, fenobarbital, valium ou diazepan e inúmeras outras, em anestésicos e antibióticos, ampicilina, imipenen e muitos outros, não farmacológicas de uso comum, as anfetaminas, metilenodióximetanfetamina ou êxtase, cocaína, morfina, heroína. Em corantes como a anilina, azul de metileno, safranina etc.
Exemplos de Aminas
Metilamina
Etilamina
1-Propanamina
1,3-propanodiamina
2-propanamina
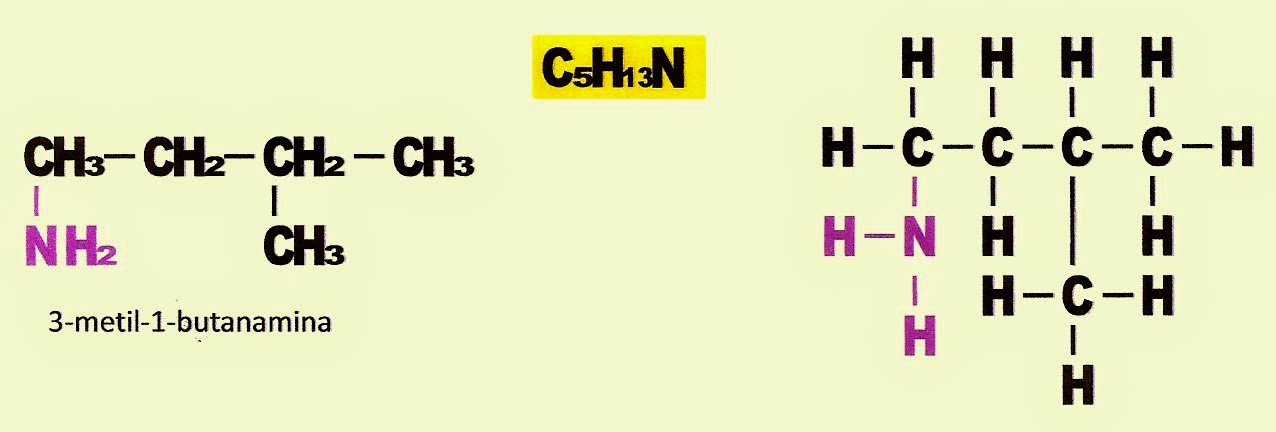
3-metil-1-butanamina
Anilina
1,4-diamino-butano (putrescina)
1,5-diamino-pentano (cadaverina)
1,5-diamino-pentano (cadaverina) ou pentano-1,5-diamina, é produzida
na hidrólise de proteínas, especialmente na descarboxilação da
lisina, é a molécula formada principalmente nos cadáveres em decomposição, se forma através dos grupos aminas das
extremidades das moléculas,
provocando o mau cheiro que exala com os gases produzidos. Aparece também em
pequenas quantidades nos vegetais e nos animais, pode ser encontrada no sêmen
conferindo o odor característico e nas infecções da vagina.
Ácido p-aminobenzóico (PABA), está presente em protetores solar.
Glifosato
O glifosato é um herbicida não seletivo, organofosforado, de caráter surfactante, utilizado em plantas pós emergentes, o seu uso representa 60% do mercado mundial de herbicidas não seletivo de baixa toxicidade comercializado. Comprova-se a baixa toxicidade porque é facilmente incorporado ao solo, também é adsorvido por argilas e plantas que o neutralizam, impedindo assim a sua passagem para a água. No entanto apesar da comprovação primordial de sua baixa toxicidade, pesquisas recentes indicam que possui certa ação irritativa dermatológica quando em contato com a pele, e além disso deletéria para genes, o que pode levar ao câncer.
No solo os micróbios degradam rapidamente o glifosato para obter
produto fosforado que será fonte de energia e nutrientes para o seu próprio
organismo.
Uma forma dessa degradação utilizada pelos micróbios, é
pela C-P liase, enzima microbiana, que transforma o glifosato em sarcosina.
A outra forma, a bactéria Anthrobacter atrocyanous, ou a Flavobacterium sp, transformam o glifosato em AMPA, ácido aminometilfosfônico, que pela
ação da enzima C-P liase se transforma em metilamina, que pela ação de outra enzima a deidrogenase se transforma em formaldeido.
Feniletilamina
Feniletilamina
A Feniletilamina é sintetizada a
partir da aminoácido etilamina, é uma molécula
estimulante do sistema nervoso central, neurotransmissora de impulsos nervosos,
e está presente também nos sentimentos de afeição, que entra funcionalmente nos
sentimentos da paixão, atuando ainda como feromonio que provoca interesses sexuais. Quando uma pessoa está
muito apaixonada ocorre o aumento dessa substância no organismo, especialmente
no cérebro.
A Feniletilamina aumenta o nível de
dopamina no cérebro, o que leva a sensação de bem estar, controla excitação e
hiperatividade, da falta de atenção, tratamento de depressão, comprova-se a sua
deficiência no mal de parkinson, reduz doenças de
pele vitiligo, osteoartrite.
Cassificação Das Aminas de Acordo Com a Substituição de Um Hidrogênio do Nitrogênio
Amina Primária
A amina primária um hidrogênio do nitrogênio é substituido um radical arila ou alquila.
Amina Secundária
Na amina secundária dois hidrogênios do nitrogênio são substituidos por radical arila ou alquila.
Amina Terciária
Na amina terciária, três hidrogênios do nitrogênio são substituidos por radical arila ou alquila.
A trimetilamina tem cheiro de peixe podre.
Aminas - Substâncias de Caráter Anfótero
Substâncias anfóteras possuem na estrutura molecular, grupos funcionais de caráter ácido e básico (amina), ao mesmo tempo.
Substâncias anfóteras possuem na estrutura molecular, grupos funcionais de caráter ácido e básico (amina), ao mesmo tempo.
Alanina
Fenialanina
Fenilalanina é o aminoácido que se
transforma noutro aminoácido
tirosina. Se não houver essa
transformação, a fenilalanina irá acumular no organismo (no
sangue), desdobrando-se na substância tóxica
ácido pirúvico, causador da fenilcetonúria. O PKU é o exame do
pezinho da criança recém nascida que determina o problema genético. A fenilcetonúria é a impossibilidade de digestão pela enzima fenilalanina hidroxilase, desse aminoácido que se
acumula, causando toxicidade
no organismo. Uma
parte é excretado pela urina
ou suor, mas se acumular no organismo, especialmente no sangue, impede vários processos metabólicos, que irá resultar na
alteração do desenvolvimento
do sistema nervoso levando a lesões neurológicas
irreversíveis, de
ordem genética, como o retardamento
mental de crianças.
A fenilalanina ainda como produto
industrializado é utilizado em adoçantes dietéticos, como o aspartame e também tem o seu emprego como adoçante de
refrigerantes.
Glicina
A Utilização Das Aminas
Metilamina
A metilamina é utilizada para a
síntese de várias substâncias, como inseticidas,
herbicidas, fungicidas, surfactantes,
também é utilizada na preparação da metanfetamina, tem o emprego no processamento de combustíveis
fósseis, na fabricação de explosivos, na industria farmacêutica para
medicamentos, na química da fotografia, em tintas e solventes, na fabricação de
borrachas.
Etilamina
Etilamina é utilizada na produção de corantes, na refinação do petróleo, é uma substância ligeiramente alcalina, empregada como estabilizador no prepara do cauchu, ou do látex da borracha, tem seu emprego como detergente, e é usada para várias sínteses orgânicas, tem emprego na preparação intermediária de tintas, corantes, pesticida, farmacêutica e na fabricação de resinas.
Propanoamina-1
Ácido p-aminobenzóicoEtilamina
Etilamina é utilizada na produção de corantes, na refinação do petróleo, é uma substância ligeiramente alcalina, empregada como estabilizador no prepara do cauchu, ou do látex da borracha, tem seu emprego como detergente, e é usada para várias sínteses orgânicas, tem emprego na preparação intermediária de tintas, corantes, pesticida, farmacêutica e na fabricação de resinas.
Propanoamina-1
Propanoamina-1 é utilizado como medicamento antidepressivo, é
sedativo e calmante, e também pode ser aplicado contra a enurese que é o ato
inconveniente de urinar na cama durante a noite. Está presente no medicamento
com o nome comercial de protanol.
Obs: não tome nenhum medicamento sem orientação médica.
1,3-propanodiamina
Obs: não tome nenhum medicamento sem orientação médica.
1,3-propanodiamina
A 1,3-propanodiamina tem aplicação na fabricação de surfactantes anfoteros, na síntese de vários produtos químicos orgânicos. Está presente em aditivos lubrificantes. Tem o
seu uso associado, formando o 3-aminopropilo-dodecilo-1,3-propanodiamina que atua como agente no tratamento da água.
Fenilamina - anilina
Fenilamina - anilina
A anilina é utilizada como precursora do índigo blue no tingimento dos tecidos “jeans”,
tem seu emprego na preparação da espuma de poliuretano, nos produtos químicos agrícolas como herbicidas, nas pinturas sintéticas, em
tinturas de cabelos roxos, vermelhos etc, em vernizes , é empregado na
preparação de antioxidantes, estabilizadores para a indústria do látex, é usado como
precursor de substâncias explosivas
(explosivos) e
também na composição do
plástico com o qual se fabrica camisinhas masculinas e femininas, e na composição do polímero de polianilina.
Anfetamina
Anfetamina
Anfetamina pura (metanfetamina) é proibida no Brasil. Nos países que ainda é liberada,
pode ser utilizada no tratamento de sintomas da depressão como estimulante de
sistema nervoso central.
Está presente nas fórmulas modificadas dos medicamentos Amphaplex, Benzedrine, Bifetamina, Dexedrine, Dexamil. Seu uso deve
acontecer somente sob orientação
médica para o tratamento da
depressão. O uso contínuo pode
levar a dependência química e problemas neurológicos.
Ácido p-aminobenzóico (PABA) numa concentração de 5% é utilizado como protetor solar, pois absorve radiação ultravioleta tipo UVB. Associado a outras substâncias, pode funcionar como medicamento. Pode estimular o crescimento de cabelos, é utilizado também como preventivo para queda de cabelos.
Nomenclatura Das Aminas
A nomenclatura das aminas segue a regra geral da química orgânica. Cita-se o nome dos radicais metil, etil, propil etc, com acréscimo do grupo funcional amina.
Nome químico ou sistemático: 1-metilamina
Nome genérico: aminometano, metilamina

Nome químico ou sistemático: 1- etilamina.
Nomes usuais: Etilamina, aminoetano, 1-aminoetano.
Nome químico ou sistemático: 1- propanamina.
Nome usual: propilamina.
Nome sistemático ou químico: 1,3-propanodiamina, propano-1,3-diamina.
Nome sistemático ou químico: 1,3,5-pentanotriamina ou pentano-1,3,5-triamina.
Nome sistemático ou químico: ácido-2,6-diamino-exanóico.
Nome usual: Lisina
A lisina é um aminácido essencial (alguns cientistas dizem ser semi-essencial porque também pode ser produzido no nosso organismo, nos intestinos por ação de bactérias, especialmente na fase de criança), é derivado do aspartato por ação de uma enzima L específica. As leveduras também podem desdobrar o alfa cetoglutarato com a acetil-CoA em lisina. Está incluida na ração animal produzida industrialmente e a sua ação nos organismos vivos em geral está em auxiliar o crescimento dos ossos, cartilagens e tecidos conectivos. No interior de muitos organismos estudados, comprovou-se que a lisina também age, em enzimas transaminases, como substrato para transaminação (transporte do grupo amina).
Reação de Substituição na formação de uma amina a partir
de um haleto e amônia.
Reação de Formação de Uma Base a Partir de Uma Amina
A metil-amina reage com água, formando a base metil-amônia e o íon hidroxila, que dá o caráter básico da solução.
As Aminas Reagem Com Ácidos Formando Sais
A metil-amina reage com o ácido clorídrico formando o sal cloreto de metil-amônia.
Exercícios
Enem - QUESTÃO 68) O glifosato (C3H8NO5P) é um herbicida
pertencente ao grupo químico das glicinas, classificado como não seletivo. Esse
composto possui os grupos funcionais carboxilato, amino e fosfonato. A degradação do glifosato no solo é muito
rápida e realizada por grande variedade de microrganismos, que usam o produto
como fonte de energia e fósforo. Os produtos da degradação são o ácido aminometilfosfônico (AMPA) e o N-metilglicina (sarcosina):
A partir do texto e dos produtos de degradação
apresentados, a estrutura química que representa o glifosato é:
a) (( )
b) ( )
c) ( )
d) ( )
e) ( )
Francisco Miragaia Peruzzo, Eduardo Leite do Canto. Química na Abordagem do Cotidiano, volume 3 Química Orgânica, editora Moderna 4ª edição, São Paulo 2010.
João Usberco, Edgard Salvador. Química, Química Orgânica 3. Editora Saraiva, 2º edição 1996
Anfetamina – Wikipédia, a enciclopédia livre
Pt.wikipedia.org/wiki/anfetamina
Anilina – Wikipedia, a enciclopédia livre
Pt.wikipedia.org/wiki/Anilina
Tito e Canto. Química na Abordagem do Cotidiano, Volume 3 Editora Moderna 2ª edição, São Paulo.
Geraldo Camargo de Carvalho. Química Moderna, vol. 3 editora Scipione, 2ª edição.
Ricardo Feltre. Química, Química Orgânica, volume 3, Editora Moderna, 6ª edição São Paulo 2004.
H.A.Harper, V.W.Rodwell,R.A. Mayes. Manual de Química Fisiológica, Editora Atheneu São Paulo.
Glifosato - SIGAM
www.sigam.ambiente.sp.gov.br/.../glifosato/20084_caractFisicoQuimica...