Os
ciclanos compreendem compostos orgânicos de carbonos com cadeias cíclicas e ligações saturadas, abrangendo os grupos dos cicloalcanos que possuem uma única
ligação saturada entre os carbonos de sua cadeia cíclica, os cicloalcenos que possuem uma única dupla ligação insaturada na sua cadeia carbônica e os cicloalcadienos que possuem duas duplas ligações
insaturadas na cadeia carbônica.
Os Cicloalcanos
Os Cicloalcanos
Exemplos de cicloalcanos
Ciclopropano
Observe nas figuras representativas que existe somente um traço de ligação entre os carbonos da cadeia.
Ciclobutano
Ciclopentano
Propil-ciclopropano
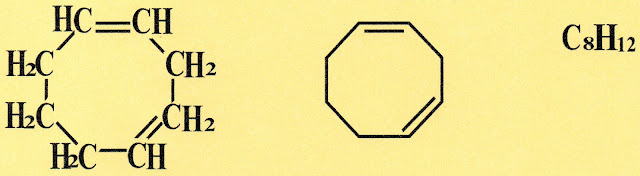
1,3-ciclooctano
Cicloalcenos
Ciclopenteno
Cicloalcadienos
1,4-hexadieno
1,4-octadieno
Alfa-bisaboleno

Usos Dos Cicloalcanos
Uso do Ciclopentano
O ciclopentano é utilizado na preparação de resinas sintéticas, adesivos de borracha, tem seu emprego como agente expansivo na produção de espuma isolante de poliuretano, substitui gases de refrigeradores e aparelhos domésticos como o CFC-11, HCFC-141-b, é utilizado em discos rígidos de computadores, tem seu uso em equipamentos de uso na estratosfera, e também serve como multi-alquilados lubrificante de ciclopentano.
Uso do Metilciclopentano
O metilciclopentano é utilizado como solvente comum, solvente para extrações em apropriadas. É também aplicado nas sínteses orgânicas e também como agente na destilação azeotrópica (que correspondem a soluções de dois ou mais líquidos que fervem à mesma temperatura).
Uso do Dicloro-1-2-ciclopropano
É utilizado para sínteses orgânicas específicas nesse
caso o 1,2-dimetilciclopropano pode
ser utilizado nas pesquisas de transformações de aminas secundárias para aminas
terciárias. E também tem aplicação como solvente de óleos, ceras, resinas e é ainda empregado como limpador de metal.
Utilização do 1,4-ciclooctano
1,4-ciclooctano é utilizado em técnica de
zimograma,
técnica eletroforética de
diagnóstico nas biotransformações pela Saccharomyces cerevisae dos
compostos de carbonos, na qual essa substância sofre oxidação por enzimas oxirredutases.
Ciclohexano
O ciclohexano é utilizado como um
dos componentes da gasolina. Também é muito utilizado como solvente na extração
de óleos de sementes de
soja, girassol etc.
Alfa-BisabolenoO A-bisaboleno está presente nos óleos essenciais do limão, nas folhas de goiabeira, no orégano. É utilizado como aditivo alimentar e em sínteses bioquímicas como do hemandulcin um adoçante natural.
Usos Dos Cicloalcenos
Uso do Metil-ciclopropeno
Metil-ciclopropeno é
conservante de flores, inibe o etileno facilitando a sua durabilidade mantendo-a
viçosa por mais tempo.
Uso do Ciclopenteno
O ciclopenteno é produzido industrialmente a partir do vinil-ciclopropano. A sua utilidade é na produção de borrachas e plásticos.
Uso do Ciclohexeno
O ciclohexeno é utilizado para pesquisa proteômica. Portanto tem o seu proveito na área da biotecnologia, que estuda o conjunto de proteínas e suas isoformas,
contidas em uma amostra biológica, seja de um organismo, seja de um tecido, ou seja de alguma organela celular ou célula, que são determinadas pelo genoma da mesma.
Uso do 1,4-hexadieno
O dieno 1,4-hexadieno (HD) é utilizado como terpolímero na polimerização para produção da borracha EPDM. O 1,4-hexadieno é o dieno que possibilita a vulcanização dessa borracha com enxofre e aceleradores convencionais
Nomenclatura Dos Ciclanos
Nomenclatura Dos Cicloalcanos
Sem Ramificação
A nomenclatura dos cicloalcanos de cadeias sem ramificação, segue as mesmas regras dos alcanos. Coloca-se inicialmente ciclo, depois conta-se o número de carbonos da cadeia com a terminação ano.
Coloca-se primeiramente ciclo, se a cadeia cíclica tem três carbonos, coloca-se "prop" mais a terminação "ano"
ciclopropano.
Coloca-se primeiramente ciclo, se a cadeia cíclica tem quatro carbonos, coloca-se "but" mais a terminação "ano"
ciclobutano.
Coloca-se primeiramente ciclo, se a cadeia cíclica tem cinco carbonos, coloca-se "pent" mais a terminação "ano"
ciclopentano.
Coloca-se primeiramente ciclo, se a cadeia cíclica tem seis carbonos, coloca-se "hexa" mais a terminação "ano"
ciclohexano.
Nomenclatura Dos Cicloalcanos Ramificados
Coloca-se primeiramente o nome do radical (no caso) de três carbonos "prop" + il + ciclo, se a cadeia cíclica tem três carbonos, coloca-se "prop" mais a terminação "ano"
propilciclopropano.
Coloca-se primeiramente a posição (ões) do radical (s) na cadeia cíclica, 1,2, depois coloca-se traço e o nome do (s) radical (is) que no caso são o metil, depois coloca-se ciclo, conta-se o número de carbonos da cadeia, que é quatro coloca-se "but" mais a terrminação "ano"
1,2-dimetil-ciclobutano
Coloca-se primeiramente as posições dos radicais 1,1,4 na cadeia cíclica,em seguida coloca-se o traço e o nome dos (s) radicais (no caso), metil, depois coloca-se ciclo, conta-se o número de carbonos da cadeia, que no caso é cinco e finalmente coloca-se "hex" mais a terrminação "ano"
1,1,4-dimetil-ciclopentano
Coloca-se primeiramente as posições dos radicais (s) na cadeia cíclica 1,3, depois coloca-se traço e o nome dos (s) radicais (no caso), metil, depois coloca-se ciclo, conta-se o número de carbonos da cadeia, que no caso é seis coloca-se "hex" mais a terrminação "ano"
1,3-dimetil-ciclohexano
Cicloalcadieno Sem Ramificação
Nos cicloalcadienos sem ramificação, coloca-se primeiramente ciclo, depois traço ou hífem, em seguida, coloca-se o número de carbonos (hexa), depois as posições das ligações insaturadas na cadeia cíclica 1,4, e por fim termina-se com dieno.
Ciclo-hexa-1,4-dieno
Isomeria Dos Ciclanos
Isomeria De um Ciclano com Um Alceno
Isomeria de Cadeia
Os ciclanos são sempre isômeros com alcenos. Aqui o ciclopropano é isômero do propeno.
Isomeria plana
Um exemplo de isomeria plana é a do 1,1-dimetil ciclobutano com o 1,2-ciclobutano.
Isomeria plana do 1-metilciclobutano com o pentano.
Isomeria Geométrica
Um exemplo de isomeria plana é a do 1,1-dimetil ciclobutano com o 1,2-ciclobutano.
Isomeria plana do 1-metilciclobutano com o pentano.
Isomeria Geométrica
Dicloro-1,2-Ciclopropano
O Dicloro-1,2-ciclopropano apresenta isomeria geométrica, observe a disposição dos átomos de cloro, que possui número atômico maior, dispostos geometricamente em lados diferentes na mesma substância.
Representações geométricas do Dicloro-1,2-ciclopropano.
Isomeria óptica
2-metil-1- ciclopropanol
Nesse caso o 2-metil-ciclopropanol é um álcool cíclico tomado como exemplo.
Observe que a mudança ocorre no eixo da hidroxila que muda de posição em relação a estrutura molecular.
Isomeria Cis-Trans
Observe que a estrutura molecular não é alterada pela mudança da posição do radical metil.
Ângulos Das Estruturas dos Cicloalcanos
Teoria das Tensões do Anel de Baeyer, Sachse, Mohr
Adolf Von Baeyer em 1885 desenvolveu a teria das tensões
de anéis, principalmente nos cicloalcanos. Ele
subdivide os ângulos em reais e teóricos, sendo que a diferença entre esses
dois ângulos é que faz com que a molécula seja mais estável. Nessas ligações, o
carbono que
possui 4
ligações simples,
existiriam 2 dessas ligações formando ângulos de 109,28’ que proporciona a
estabilidade da molécula.
Ângulo Real e Teórico
Contudo para Sachse e Mohr, pesquisadores que propuseram em sua teoria, explicar a estabilidade de certas moléculas como
o hexano. Eles propunham que para ser estável os ângulos das moléculas como o hexano, deveriam
ser de 109°,28’, sendo que moléculas com ângulos de 60° como a do ciclopropano seriam mais instáveis e reagiriam como maior facilidade. Baeyer propunha então que existiriam ângulos reais e teóricos. E outra proposta também dizia que, quanto
maior
for a diferença entre o ângulo real e o ângulo teórico de uma substância mais
instável é a substância e portanto maior a instabilidade do ciclo e facilidade de
reagir quebrando o anel.
Vejamos exemplos de ângulos real e teórico
de diferentes substâncias.
Nesse esquema o ciclopropano apresenta ângulos reais de 60º e ângulos teóricos de 109°,28' a diferenças entre os ângulos são maiores, então essa substância é mais instável.
O ciclobutano possui ângulos reais de 90° e ângulos teóricos de 109°,28' a diferença é menor portanto ela possui uma instabilidade menor que a do ciclopropano.
O ciclopentano possui ângulos reais de 108° e ângulos teóricos de 109°,28', a diferença entre o real e o teórico é mínima, portanto essa substância é a mais estável das três.
Estruturas Espaciais Interconversíveis
Agora vejamos a estrutura do ciclohexano a qual apresenta estruturas
espaciais própria, apresentando-se em forma de cadeira ou de barco com ângulos de 108°,28’ o
que facilita a estabilidade da molécula que não se “quebra” facilmente.
A mesma conformidade mostrando os ângulos abaixo.
Reações dos Cicloalcanos
Reação de Substituição
Produção de Bromociclopentano
O ciclopentano possui 5
carbonos e 10 hidrogênios, reage com o bromo na presença de luz. Um hidrogênio
do ciclopentano é
substituído por um átomo de bromo formando o bromociclopentano, restando ácido bromídrico.
Reação de Adição
Adição de Halogênios Produção de Dicloro-Hexano
A partir do ciclo-hexeno com a substituição de dois átomos de hidrogênio por cloro é produzido o 1,2-dicloro-ciclohexano
Reação de oxidação
Produção de um Ciclo-Álcool a Partir do Penteno
Na reação de oxidação do ciclopenteno, um alceno, é adicionado íon permanganato e água, ocorre o rompimento de uma das ligações da dupla ligação do alceno, e no lugar são inseridos duas hidroxilas produzindo um ciclo-álcool.
Reação de oxidação
Produção do ácido propanóico a partir do ciclopropano.
O ciclopropano reage com o oxigênio produzindo o ácido propanóico ou etanocarboxílico, ou metilacético. Essa substância é usada como aditivo alimentar, solvente químico para agricultura, farmacêutica, perfumaria e derivados da celulose.
A reação é Enérgica, pode acontecer com um ciclano, alceno, alcino, álcool etc, com a utilização do reagente de Baeyer em meio ácido, que gera ácidos carboxílicos ou álcool.
Reação
de preparação do ciclohexa-1,4-dieno
O
dibromo-ciclo-hexano reage com hidreto
de sódio transformando-se em ciclohexa-1-4-dieno, brometo de sódio e gás
hidrogênio.
Ou podemos fazer a representação da mesma reação abaixo.
Reação de Preparação do Pentano
O ciclopentano aparece normalmente nos derivados naftênico do petróleo, mas pode também ser preparado industrialmente pela ciclização de frações do petróleo.
1) Os ciclanos compreendem compostos orgânicos de carbonos cadeias cíclicas com:
a) todas ligações saturadas entre os carbonos de sua cadeia.
b) uma ligação insaturada, uma dupla ligação insaturada, duas duplas ligações insaturadas.
c) uma ligação saturada entre os carbonos, uma dupla ligação insaturada, duas duplas ligações insaturadas.
d) uma ligação saturada entre os carbonos, uma dupla ligação saturada, duas duplas ligações insaturadas.
e) uma tripla ligação saturada entre os carbonos, uma dupla ligação insaturada, duas duplas ligações saturadas.
2) Quando nos referimos aos ciclanos, estamos tratando assuntos relativos às substâncias pertencentes aos grupos dos:
a) todas ligações saturadas entre os carbonos de sua cadeia.
b) uma ligação insaturada, uma dupla ligação insaturada, duas duplas ligações insaturadas.
c) uma ligação saturada entre os carbonos, uma dupla ligação insaturada, duas duplas ligações insaturadas.
d) uma ligação saturada entre os carbonos, uma dupla ligação saturada, duas duplas ligações insaturadas.
e) uma tripla ligação saturada entre os carbonos, uma dupla ligação insaturada, duas duplas ligações saturadas.
2) Quando nos referimos aos ciclanos, estamos tratando assuntos relativos às substâncias pertencentes aos grupos dos:
a) ciclanos, cicloalcenos e
benzênicos.
b) cicloalcanos, fenantrenos e naftalênicos.
c) cicloalcanos, cicloalcenos e cicloalcadienos.
d) alcanos, alcenos e alcadienos.
e) ciclobenzeno, cicloalcenos e cicloalcadienos.
3) A estrutura a seguir é chamada de:
a) cicloalcano.
b) ciclopropano.
c) etil-ciclopropano.
d) Propil-1-ciclopropano.
e) propil-1-ciclobutano.
a) reais e teóricos.
b) maiores que 120°.
c) de 60°, 90º e 120°.
d) maiores que 120° porque todas as substâncias reagem.
e) menores que 109º,28' pois a maioria das substâncias não reagem.
4) Das estruturas a seguir é o ciclopentano:
5) A estrutura a seguir está presente em
óleos essenciais do limão, das folhas de goiabeira e no orégano.
Essa estrutura é a da substância:
a) limoneno.
b) a-bisaboleno.
c) licopeno.
d) naftaleno.
e) nitrotolueno.
6) Uma substância que é utilizada em técnica de zimograma, que é uma técnica eletroforética de diagnóstico nas biotransformações pela Saccharomyces cerevisae dos compostos de carbonos, na qual essa substância sofre oxidação por enzimas oxirredutases é o:
a) dicloro-1-2-ciclopropano.
b) propil-1-ciclobutano.
c) 1,4-ciclooctano.
b) propil-1-ciclobutano.
c) 1,4-ciclooctano.
d) metilciclopentano.
e) 2-metil-1- ciclopropanol.
7) A substância conservante de flores, que inibe o etileno facilitando a sua durabilidade, mantendo-a viçosa por mais tempo é o:
a) propil-1-ciclobutano.
b) 2-metil-1- ciclopropanol.
c) propil-1-ciclopropano.
d) ciclohexa-1,4-dieno.
e) metil-ciclopropeno.
8) São representadas as estruturas de 4 substâncias Abaixo.
A nomenclatura respectivamente correta dessas substâncias são:
a) cihexano, 1,3-dimetil-ciclohexano, ciclo-hexa-1,4-dieno e ciclobutano.
b) ciclopropano, 1,3-dimetil-ciclohexano, ciclo-hexa-1,4-dieno e ciclobutano.
c) 1,3-dimetil-ciclohexano, 1,3-dimetil-ciclohexano, ciclo-hexa-1,4-dieno e ciclobutano.
d) 1,4-dieno-ciclobutano, propilciclopropano , ciclopentano e 1,1,4-dimetil-ciclopentano.
e) 1,1,3-dimetil-ciclopentano, 1,3-dimetil-ciclohexano, ciclo-hexa-1,4-dieno e ciclobutano.
9) As representações do Dicloro-1,2-ciclopropano logo abaixo trata-se de isomeria:
a) óptica.
b) cis-Trans.
c) geométrica.
d) de Cadeia.
e) de função.
10) Numa reação de oxidação do ciclopenteno, um alceno, é adicionado íon permanganato e água, ocorre o rompimento de uma das ligações da dupla ligação do alceno, e no lugar são inseridos duas hidroxilas produzindo um:
a) diclorohexano
b) cicloálcool
c) ciclohexa-1-4-dieno
d) bromociclopentano
e) ácido carboxílico
11) Sachse e Mohr, pesquisadores que propuseram em sua teoria, explicar a estabilidade de certas moléculas como o hexano. Eles propunham que para ser estável os ângulos das moléculas como o hexano, deveriam ser de 109°,28’, sendo que moléculas com ângulos de 60° como a do ciclopropano seriam mais instáveis e reagiriam como maior facilidade. Baeyer propunha então que existiriam ângulos:
e) 2-metil-1- ciclopropanol.
7) A substância conservante de flores, que inibe o etileno facilitando a sua durabilidade, mantendo-a viçosa por mais tempo é o:
a) propil-1-ciclobutano.
b) 2-metil-1- ciclopropanol.
c) propil-1-ciclopropano.
d) ciclohexa-1,4-dieno.
e) metil-ciclopropeno.
8) São representadas as estruturas de 4 substâncias Abaixo.
A nomenclatura respectivamente correta dessas substâncias são:
a) cihexano, 1,3-dimetil-ciclohexano, ciclo-hexa-1,4-dieno e ciclobutano.
b) ciclopropano, 1,3-dimetil-ciclohexano, ciclo-hexa-1,4-dieno e ciclobutano.
c) 1,3-dimetil-ciclohexano, 1,3-dimetil-ciclohexano, ciclo-hexa-1,4-dieno e ciclobutano.
d) 1,4-dieno-ciclobutano, propilciclopropano , ciclopentano e 1,1,4-dimetil-ciclopentano.
e) 1,1,3-dimetil-ciclopentano, 1,3-dimetil-ciclohexano, ciclo-hexa-1,4-dieno e ciclobutano.
9) As representações do Dicloro-1,2-ciclopropano logo abaixo trata-se de isomeria:
a) óptica.
b) cis-Trans.
c) geométrica.
d) de Cadeia.
e) de função.
10) Numa reação de oxidação do ciclopenteno, um alceno, é adicionado íon permanganato e água, ocorre o rompimento de uma das ligações da dupla ligação do alceno, e no lugar são inseridos duas hidroxilas produzindo um:
a) diclorohexano
b) cicloálcool
c) ciclohexa-1-4-dieno
d) bromociclopentano
e) ácido carboxílico
11) Sachse e Mohr, pesquisadores que propuseram em sua teoria, explicar a estabilidade de certas moléculas como o hexano. Eles propunham que para ser estável os ângulos das moléculas como o hexano, deveriam ser de 109°,28’, sendo que moléculas com ângulos de 60° como a do ciclopropano seriam mais instáveis e reagiriam como maior facilidade. Baeyer propunha então que existiriam ângulos:
a) reais e teóricos.
b) maiores que 120°.
c) de 60°, 90º e 120°.
d) maiores que 120° porque todas as substâncias reagem.
e) menores que 109º,28' pois a maioria das substâncias não reagem.
Referencias Bibliográficas
João Usberco, Edgard SalvadorQuímica, química orgânica, vol. 3. Editora Saraiva 2ª Edição 1996. São Paulo - SP.
Borracha de Etileno-Propileno-Dieno (EPDM) Rubberpedia - portal ...
www.rubberpedia.com/borracha-epdm.phd
Aline Thais Bruni, Ana Lucia Petillo Nery, André Amaral Gonçalves Bianco, Egidio Trambaiolli Neto, Henrique Rodrigues, Kátia Santina, Rodrigo Marchiori Liegel Vera Lucia Aoki. Ser Protagonista Química. Ensino Médio, 3º Ano, Volume 3. Edicões SM Ltda, São Paulo SP, 2ª edição 2013.
Ricardo Feltre. Química, Química Orgânica Volume 3. Editora Moderna, 6ª edição São Paulo 2004.
Francisco Miragaia Peruzzo, Eduardo Leite do Canto. Tito & Canto. Química na Abordagem do Cotidiano. Volume 3, Editora Moderna, 2ª Edição, São Paulo SP.
Synthesis of tertiary amines containing. gem-diclhlrocyclopropane and...
https://link.springer.com/article10,1134/S1070427216050116
Dalton Franco. Química, Ensino Médio, química orgânica volume 3, Editora FTD. São Paulo 2009.
Francisco Miragaia Peruzzo, Eduardo Leite Canto. Química na Abordagem do Cotidiano, Química Orgânica, volume 3, 2ª edição. Editora Moderna 1999. São Paulo.
Referencias Bibliográficas
João Usberco, Edgard SalvadorQuímica, química orgânica, vol. 3. Editora Saraiva 2ª Edição 1996. São Paulo - SP.
Borracha de Etileno-Propileno-Dieno (EPDM) Rubberpedia - portal ...
www.rubberpedia.com/borracha-epdm.phd
Aline Thais Bruni, Ana Lucia Petillo Nery, André Amaral Gonçalves Bianco, Egidio Trambaiolli Neto, Henrique Rodrigues, Kátia Santina, Rodrigo Marchiori Liegel Vera Lucia Aoki. Ser Protagonista Química. Ensino Médio, 3º Ano, Volume 3. Edicões SM Ltda, São Paulo SP, 2ª edição 2013.
Ricardo Feltre. Química, Química Orgânica Volume 3. Editora Moderna, 6ª edição São Paulo 2004.
Francisco Miragaia Peruzzo, Eduardo Leite do Canto. Tito & Canto. Química na Abordagem do Cotidiano. Volume 3, Editora Moderna, 2ª Edição, São Paulo SP.
Synthesis of tertiary amines containing. gem-diclhlrocyclopropane and...
https://link.springer.com/article10,1134/S1070427216050116
Dalton Franco. Química, Ensino Médio, química orgânica volume 3, Editora FTD. São Paulo 2009.
Francisco Miragaia Peruzzo, Eduardo Leite Canto. Química na Abordagem do Cotidiano, Química Orgânica, volume 3, 2ª edição. Editora Moderna 1999. São Paulo.