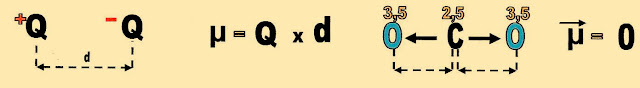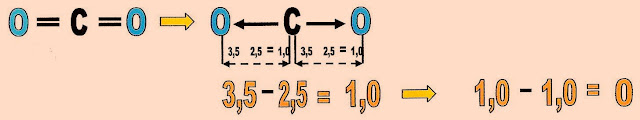Eletronegatividade
Eletronegatividade de um elemento químico é a capacidade que o átomo possui de receber ou “puxar” elétron (s) de outro (s) átomo (s). Os átomos participantes com maior eletronegatividade são ametais.
O flúor é o mais eletronegativo dos átomos, na escala da eletronegatividade de Linus Pauling está classificado com o número 4,0. O césio, o rubídio e o frâncio são os menos eletronegativos de todos os átomos com 0,8 na escala de eletronegatividade, são portanto; considerados átomos eletropositivos.
Existe uma variedade de escalas de eletronegatividade, a mais utilizada é a de Linus Pauling, a que adotamos.
Fila de Pauling de Eletronegatividades Decrescentes
A tabela a seguir foi compilada pela consulta a várias outras, de diferentes publicações sendo aproveitado os valores observados em cada uma delas, alguns desses valores de eletronegatividade foram arredondados para cima e outros para baixo conforme cada uma delas apresentava. Por esse motivo ao consultarem outras tabelas de escritores diferentes, verão que os números podem diferenciar um pouco, mas todos eles obedecem os parâmetros de Linus Pauling.
A fila de Pauling de Eletronegatividades Decrescentes
Colocando os mesmos valores eletronegativos de cada átomo, na ordem da tabela periódica, ficam assim distribuídos:
A Eletronegatividade de Cada Elemento Químico da Tabela Periódica
A Eletronegatividade de Cada Elemento Químico da Tabela Periódica
Com exceção dos gases nobres e dos elementos químicos que não são naturais (sintéticos), a eletronegatividade de cada um, pode ser representada com os valores aproximados como no esquema abaixo.
A Diferença de Polaridade - Eletronegatividade
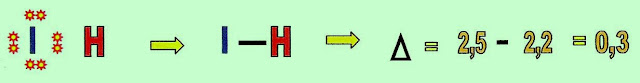
Podemos observar a diferença de polaridade entre átomos, comparando a eletronegatividade do hidrogênio com a sua polaridade em relação a outros átomos de maior eletronegatividade.
Observa-se que quanto mais aumenta a eletronegatividade do átomo, ele “puxa” o par eletrônico para perto de si.
O gás hidrogênio formado por átomos de polaridade igual mantém os elétrons no centro da linha intermediária, na sequência o iodo é mais eletronegativo que o hidrogênio, atrai o par eletrônico mais próximo a si, finalmente o flúor o átomo mais eletronegativo aproxima muito mais o par eletrônico.
O gás hidrogênio formado por átomos de polaridade igual mantém os elétrons no centro da linha intermediária, na sequência o iodo é mais eletronegativo que o hidrogênio, atrai o par eletrônico mais próximo a si, finalmente o flúor o átomo mais eletronegativo aproxima muito mais o par eletrônico.
 |
| A tabela mostra os elementos químicos mais eletronegativos puxando o par de elétrons para si. |
A Molécula e Seu Polo Elétrico e Dipolos Instantâneos
A molécula do ácido clorídrico nos dá uma ideia bem clara da polaridade em sua estrutura. Considerando que a ligação entre os dois átomos dessa molécula se faz pela interpenetração dos dois orbitais que possui apenas um elétron cada, um para cada átomo, formando a ligação sigma s, s. Além disso como se sabe nesse caso, o cloro sendo mais eletronegativo atrai o par de elétrons para a sua proximidade favorecendo o desequilíbrio das cargas, deixando o lado da molécula em que está o hidrogênio positivo e o seu oposto negativo.
Dipolos Instantâneos
De outra forma, sabemos que o elétron está sempre em constante movimento, próximo a velocidade da luz em seus orbitais e pode ser encontrado ao mesmo tempo em todas as posições desse orbital, no entanto; em dado instante o lado da molécula em que está o cátion hidrogênio se torna momentaneamente positivo e o lado em que está o ânion cloro se torna da mesma forma momentaneamente negativo, criando assim os polos positivo e negativo molecular.
Dipolos Instantâneos
De outra forma, sabemos que o elétron está sempre em constante movimento, próximo a velocidade da luz em seus orbitais e pode ser encontrado ao mesmo tempo em todas as posições desse orbital, no entanto; em dado instante o lado da molécula em que está o cátion hidrogênio se torna momentaneamente positivo e o lado em que está o ânion cloro se torna da mesma forma momentaneamente negativo, criando assim os polos positivo e negativo molecular.
δ - letra sigma minúscula
A molécula do ácido clorídrico representada acima, pode ser utilizada como exemplo, sendo altamente ionizável na água, possui em um lado de sua estrutura molecular o átomo de hidrogênio, de caráter eletropositivo e do outro lado o átomo de cloro caracteristicamente negativo.
Os Tipos Diferentes de Ligações e Suas Polaridades
Abaixo destaca-se no primeiro plano, a ligação entre o sódio e o hidrogênio, formando o hidreto de sódio (NaH) composto iônico com característica altamente polar.
Em seguida observamos a ligação covalente polar entre o hidrogênio e o flúor formando o fluoreto de hidrogênio (HF) ligação covalente que dá a característica à molécula ser altamente polarizada.
Por último observamos a molécula do gás flúor (F2) formado por ligação covalente apolar. As cargas das partículas são idênticas, portanto não ocorre polaridade na molécula formada.
Abaixo destaca-se no primeiro plano, a ligação entre o sódio e o hidrogênio, formando o hidreto de sódio (NaH) composto iônico com característica altamente polar.
Em seguida observamos a ligação covalente polar entre o hidrogênio e o flúor formando o fluoreto de hidrogênio (HF) ligação covalente que dá a característica à molécula ser altamente polarizada.
Por último observamos a molécula do gás flúor (F2) formado por ligação covalente apolar. As cargas das partículas são idênticas, portanto não ocorre polaridade na molécula formada.
Ligação iônica Ligação covalente Ligação covalente Polar polar apolar
O Delta (Δ) Representando a Diferença do Potencial Elétrico
A representação da polaridade de uma molécula, é proporcional à diferença entre o delta maiúsculo, (Δ) ou seja; a diferença entre os potenciais eletronegativos dos elementos químicos unidos numa molécula. Δ é zero quando essa diferença for nula ou zero não há polaridade na molécula. Quando Δ for menor que 1,7 a molécula possui pouca polaridade. Quando Δ for maior que 1,7 a molécula é altamente polar e o tipo de ligação que liga os átomos é do tipo iônica.
Ligação Apolar - Moléculas Apolares
A molécula do gás hidrogênio (H2) (a seguir) é apolar pois a carga de suas partículas são iguais. O delta, resultado da diferença da subtração entre os dois valores é zero.
A molécula do gás hidrogênio (H2) (a seguir) é apolar pois a carga de suas partículas são iguais. O delta, resultado da diferença da subtração entre os dois valores é zero.
A molécula do gás flúor (F2) (a seguir) é apolar pois a carga de suas partículas são iguais. O delta, resultado da diferença da subtração entre os dois valores é zero.
Ligação Com Pouca Polaridade - Moléculas Com Pouca Polaridade Δ < 1,7
Ligação Com Maior Polaridade – Moléculas Com Maior Polaridade Δ < 1,7
Molécula apolar
A Molécula da Amônia
A amônia é outro exemplo de molécula polar. A sua configuração estrutural faz com que um dos lados da molécula seja um pouco "mais" positivo e o outro "mais" negativo.
Como o assunto a respeito da geometria molecular no momento não terá um porte mais aprofundado, pois ultrapassa os limites para ensino médio, fica aqui algumas indicações de autores de livros à pesquisar.
Molecular Geometry, Van Nostrand Reinhold, London, 1972, 226 pages.
Questões
1) Eletronegatividade de um elemento químico é a capacidade que o átomo possui de :.......................................Os átomos participantes com maior.....................................são ametais.
a) doar elétron (s) para outro (s) átomo (s), eletropositividade.
b) perder cargas (s) de outro (s) átomo (s), eletronegatividade.
c) receber prótons de outro (s) átomo (s), número de prótons.
d) receber nêutrons de outra molécula, apolaridade.
e) receber elétron (s) de outro (s) átomo (s), eletronegatividade.
2) de acordo com a fila de Pauling de eletronegatividades decrescentes, os elementos químicos com maiores e menores polaridades são:
a) Fr; O; Ni; Cl, Br e F; Cs; Rb; K, Al.
b) Rb; K; N; Cl, Br e Fr; Cs; F; Cl, Na.
c) Fr; O; Na; Cl, Br e F; Cs; Rb; K, N.
d) F; O; N; Cl, Br e Fr; Cs; Rb; K, Na.
e) Na; K; Rb; Cs, Fr e F; O; N; Cl, Br.
3) Observe a tabela abaixo.
Nessa tabela observa-se que quanto mais eletronegativo é o átomo, que se liga ao hidrogênio, ele ......................................................................
a) puxa o iodo para perto de si.
b) puxa o par eletrônico para perto de si.
c) empurra o bromo para longe de si.
d) deixa o par eletrônico afastado de si.
e) afasta os átomos de si.
3) Das substâncias apresentadas logo abaixo, se enquadram como, apolar, com pouca polaridade e altamente polar respectivamente apenas a alternativa:
a) NaCl, AlF3, FrF.
b) H2, F2, O2.
c) HI, HBr, H2S.
d) H2, HBr, NaCl.
e) NaCl, H2S, N2.
4) Dada as moléculas abaixo, descreva a alternativa que indica se são; polar, pouco polar ou apolar, respectivamente.
5) Observando a estrutura molecular plana do hidreto de berílio (BeH2), podemos ver que aqui devido a sua disposição linear plana que:
a) ocorre a diferença de potencial elétrico, mas não anula a polaridade.
b) ocorre a diferença de potencial elétrico com a anulação da polaridade.
c) ocorre a anulação do potencial elétrico com a diferença da polaridade.
d) ocorre a diferença de potencial elétrico com a diferença da polaridade.
e) ocorre a anulação do potencial elétrico com a anulação da polaridade.
Ligação Altamente Polar – Ligação Iônica, Δ = ou > 1,7
Observe a diferença de eletronegatividade entre o sódio (Na) e o cloro (Cl) do sal cloreto de sódio que leva à alta polarização desse composto iônico.
Observe a diferença de eletronegatividade entre o sódio (Na) e o cloro (Cl) do sal cloreto de sódio que leva à alta polarização desse composto iônico.
Igualmente acontece o mesmo fenômeno com o fluoreto de alumínio. O flúor é muito eletronegativo, e o alumínio apesar de não ser tão eletropositivo, a interação entre os dois elementos químicos produz uma diferença grande entre suas cargas, levando a ser um composto altamente polarizado.
Observe a sua estrutura e a diferença de suas cargas esquematizadas abaixo.
Vetor Polaridade
Ligações Polares Nas Moléculas Apolares
Nem sempre as moléculas com ligações polares são polares. Há moléculas com ligações polares que são apolares. Vejamos o exemplo abaixo do hidreto de berílio que mesmo tendo diferença de potencial elétrico é molécula apolar.
 |
| Podemos ver que aqui ocorre a diferença de potencial elétrico com a anulação da polaridade. |
Podemos visualizar esse fenômeno na estrutura da molécula do hidreto de berílio (BeH2), que forma a substância usada como combustível para foguetes, apresenta a sua estrutura de forma linear. O hidrogênio com a eletronegatividade 2,2 numa extremidade se liga a um átomo de berílio com eletronegatividade 1,5 que fica no centro da molécula, que se liga a outro hidrogênio na outra extremidade da molécula. Essa linearidade molecular, neutraliza a diferença da eletronegatividade. É como um cabo de guerra, com um ponto central que não pode se deslocar. Quando se aplica uma força em uma extremidade esta, tende a puxar para seu lado o ponto central, no entanto há uma força de igual proporção do outro lado que equilibra as forças mantendo fixo o ponto central que não se desloca.
Vetor Polaridade e Sua Anulação
Molécula Apolar
Molécula Apolar
Dependendo da configuração geométrica da molécula ela pode ser apolar. No caso do tricloreto de boro BCl3 a estrutura geométrica forma três ângulos de 120º o que cria um ponto de equilíbrio no centro e dá a molécula a característica apolar.
Os vetores se anulam
molécula apolar
Momento Dipolar - Apolaridade
O momento dipolar que é uma grandeza vetorial, ou é ainda; a direção do vetor que parte dos centros das cargas positiva para o das cargas negativa.
É representado pela letra μ (mi) que é o resultado da carga eletronegativa Q ou a diferença entre as distâncias dos centros das cargas opostas representadas pela letra d.
Esquematicamente a representação fica:
Outro caso bem típico para ser mostrado é o da molécula de gás carbônico que é formada por duas ligações polares. No entanto, pelo fato da molécula possuir a estrutura linear com os vetores de sentidos contrários estes se anulam.
Observe que para simplificar o enunciado foi utilizado a diferença da eletronegatividade de cada elemento químico participante na molécula do gás carbônico, para elucidar a anulação da polaridade da molécula.
Vetores Polaridade que Não se Anulam
A Molécula da Água
A molécula da água representada na forma "bidimensional" tem a característica polar.
Os dois valores de eletronegatividade não se anulam devido a disposição geométrica espacial de seus átomos. O lado do átomo do oxigênio tem maior eletronegatividade e o lado dos dois átomos de hidrogênio de menor eletronegatividade é positivo. Portanto a molécula é polar.
A molécula da água representada na forma "bidimensional" tem a característica polar.
Os dois valores de eletronegatividade não se anulam devido a disposição geométrica espacial de seus átomos. O lado do átomo do oxigênio tem maior eletronegatividade e o lado dos dois átomos de hidrogênio de menor eletronegatividade é positivo. Portanto a molécula é polar.
A Molécula da Amônia
A amônia é outro exemplo de molécula polar. A sua configuração estrutural faz com que um dos lados da molécula seja um pouco "mais" positivo e o outro "mais" negativo.
Como o assunto a respeito da geometria molecular no momento não terá um porte mais aprofundado, pois ultrapassa os limites para ensino médio, fica aqui algumas indicações de autores de livros à pesquisar.
Molecular Geometry, Van Nostrand Reinhold, London, 1972, 226 pages.
Atoms, Molecules and Reactions: An Introduction to Chemistry with D.A. Humphreys, E.A. Robinson and D.R. Eaton, Prentice Hall, 1994, 750 pages.
Questões
1) Eletronegatividade de um elemento químico é a capacidade que o átomo possui de :.......................................Os átomos participantes com maior.....................................são ametais.
a) doar elétron (s) para outro (s) átomo (s), eletropositividade.
b) perder cargas (s) de outro (s) átomo (s), eletronegatividade.
c) receber prótons de outro (s) átomo (s), número de prótons.
d) receber nêutrons de outra molécula, apolaridade.
e) receber elétron (s) de outro (s) átomo (s), eletronegatividade.
2) de acordo com a fila de Pauling de eletronegatividades decrescentes, os elementos químicos com maiores e menores polaridades são:
a) Fr; O; Ni; Cl, Br e F; Cs; Rb; K, Al.
b) Rb; K; N; Cl, Br e Fr; Cs; F; Cl, Na.
c) Fr; O; Na; Cl, Br e F; Cs; Rb; K, N.
d) F; O; N; Cl, Br e Fr; Cs; Rb; K, Na.
e) Na; K; Rb; Cs, Fr e F; O; N; Cl, Br.
3) Observe a tabela abaixo.
a) puxa o iodo para perto de si.
c) empurra o bromo para longe de si.
d) deixa o par eletrônico afastado de si.
e) afasta os átomos de si.
3) Das substâncias apresentadas logo abaixo, se enquadram como, apolar, com pouca polaridade e altamente polar respectivamente apenas a alternativa:
a) NaCl, AlF3, FrF.
b) H2, F2, O2.
c) HI, HBr, H2S.
d) H2, HBr, NaCl.
e) NaCl, H2S, N2.
4) Dada as moléculas abaixo, descreva a alternativa que indica se são; polar, pouco polar ou apolar, respectivamente.
a) O
═ O H ─ H Cl ─ Cl
b) N ≡
N H ─ S ─ H F ─ F
c) H
─ H H
─ Br Na+
- Cl
d) Na+
- Cl H ─ I Cl ─ Cl
e) Fr+
- F K+- F Al3+- F3
5) Observando a estrutura molecular plana do hidreto de berílio (BeH2), podemos ver que aqui devido a sua disposição linear plana que:
a) ocorre a diferença de potencial elétrico, mas não anula a polaridade.
b) ocorre a diferença de potencial elétrico com a anulação da polaridade.
c) ocorre a anulação do potencial elétrico com a diferença da polaridade.
d) ocorre a diferença de potencial elétrico com a diferença da polaridade.
e) ocorre a anulação do potencial elétrico com a anulação da polaridade.
6) A configuração estrutural
geométrica da amônia faz com que um dos lados da molécula seja um pouco
"mais" positivo e o outro "mais" negativo.
a)
linear plana.
b) apolar.
c) polar.
d) bipolarizada.
e) em que os vetores se anulam.