Os Estados Físicos Dos Alcinos
Os alcinos se apresentam no meio ambiente normal nos estados gasosos, líquidos e sólidos. Os alcinos com cadeias carbônicas com até 4 carbonos são gasosos, com 5 até 15 carbonos são líquidos e os com cadeias carbônicas principal acima de 15, são sólidos.
A Densidade Dos Alcinos
Os alcinos são mais densos que os alcanos, mas são menos densos que a água.
A Solubilidade Dos Alcinos
Os alcinos são quase insolúveis em água, portanto o acetileno tem uma fraca solubilidade na água, um litro de água dilui 1 litro de acetileno. A acetona é um ótimo solvente do acetileno, 1 litro de acetona dilui 300 litros de acetileno.
Exemplos Dos Alcinos Mais Comuns
Acetileno ou Etino (C2H2)
Propino ou Alileno (C3H6) - apresentado nas fórmulas molecular condensada e estrutural plana.
Butino (C4H6) - apresentado nas fórmulas molecular condensada e estrutural plana. IUPAC but-2-ino.
Pentino (C5H8). IUPAC pent-2-ino
Hexino (C6H10) IUPAC Hex-2-ino
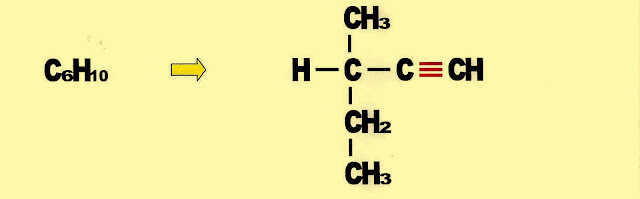
2-metil-3-pentino (C6H10) IUPAC 2-metil-pent-3-ino
Utilização Dos Alcinos
O Acetileno
A Importância do Acetileno
O acetileno é o mais importante dos alcinos, é incolor, inodoro. Quando apresenta cheiro desagradável é devido às impurezas.
O acetileno possui grau 4 de inflamabilidade que é muito alto, apresenta ainda grau 1 ou leve quanto a danos á saúde, sendo no entanto muito asfixiante e se enquadra no grau 3 ou grave, porque pode explodir quando comprimido.
Por ter a capacidade de deslocar o oxigênio do ar, esse gás deve ser utilizado conforme recomendações, por ser tóxico para o ser humano e ao meio ambiente, especialmente se o local for fechado. É armazenado em cilindros de aço, que no seu interior contém terras infusórias que é um material poroso, juntamente com a acetona, no qual dissolve bastante o acetileno. O material poroso mais a acetona evita a detonação da solução (acetona + acetileno) muito sensível á choques.
Obtenção do Acetileno
É obtido do calcário CaCO3, (Carbonato de cálcio) que vai ao forno, sofre queima e transforma em CaO (Cal viva) que é misturada ao carvão coque, vão para o forno elétrico, transformando-o em CaC2 (carbeto de cálcio) que sofrendo a hidrólise se transforma em acetileno. É obtido do petróleo por craking, que produz eteno, que por desidrogenação a alta temperatura se transforma em acetileno. Também pode ser obtido a partir do carvão hulha.
Utilização do Acetileno
Uso na Fabricação de Borrachas Sintéticas
O acetileno é usado na fabricação de borracha sintética. Primeiramente o acetileno é transformado em vinil acetileno, posteriormente o vinil acetileno é transformado em butadieno ou cloropreno que são utilizados na fabricação de borrachas sintéticas.
Uso Como Gás de Lampião
Nos lugares remotos onde não há eletricidade o acetileno pode ser usado como gás de lampião, sua luz é muito clara. Por produzir uma quantidade considerável de gás, num período relativamente prolongado, pode ser empregado nas pesquisas, em espeleologia.
Uso Como Gás de Maçarico
O acetileno é utilizado para cortar chapas de aço. Na forma de oxi-acetileno produz temperaturas elevadíssimas que é capaz de cortar chapas de aço. A chama do acetileno, de cor azulada alcança a temperatura de 3000 ºC, o que faz as peças a serem soldadas fundirem-se com a solda.
A foto abaixo mostra um recipiente com gás e o maçarico de acetileno.
A foto abaixo mostra um recipiente com gás e o maçarico de acetileno.
Uso do Acetileno na Produção de Plásticos P.V.C.
Nessa produção, primeiramente o acetileno é transformado em cloreto de vinila e depois o cloreto de vinila é polimerizado, formando o policloreto de vinila P.V.C. Esse plástico servia para fabricação de discos de vinil, atualmente é usado como matéria prima dos CDs. Outro plástico o policarbonato que falaremos mais adiante também é utilizado no revestimento de CDs. Como já tínhamos visto anteriormente, o P.V.C. é usado para
produção de uma variedade de produtos industriais.
Uso na Produção do Plástico P.V.A.
Na Produção do Plástico P.V.A., primeiramente o acetileno é transformado em acetato de vinila. Posteriormente o acetato de vinila é transformado em poliacetato de vinila e depois no plástico P.V.A. Além do P.V.A.,com o acetato de vinila pode-se obter uma série de outras compostos como: películas plásticas de revestimento e proteção, sprays para cabelo, laquês, tintas a base d’água, revestimento de papel, materiais de acabamento e impregnação, e adesivos. Com o poliacetato de vinila pode-se também fabricar gomas de mascar.
Uso na Produção de Orlon Crylon
Para formar o orlon ou crylon (fibras têxteis), primeiramente o acetileno é transformado num monômero e posteriormente em polímero de acrilonitrila, depois na fibra sintética orlon. Com essas fibras são confeccionadas cobertores, mantas, tapetes, carpetes e bichos de pelúcia.
O Acetileno na Produção de Ácido Acético
O acetileno é transformado por hidratação catalítica em acetaldeido e depois em ácido acético.
Acetileno e a Produção de Solventes Orgânicos
O acetileno é desdobrado na forma de dicloro-etileno ou tetracloralcano que são solventes clorados.
Os Acetiletos – Alcinos Que Produzem Explosivos
Os alcinos que possuem hidrogênios ligados diretamente no carbono de ligação tripla. Esse hidrogênio tem caráter levemente ácido e pode ser substituído por metais pesados como a prata (Ag), cobre (Cu), etc. dando origem a acetiletos.
Os Acetiletos Quando Secos São Explosivos
Os acetiletos formados por metais pesados, quando secos, são explosivos violentos, sendo utilizados em detonadores.
But-1-ino But-2-ino
A produção do acetileno pode ser mostrado no esquema logo abaixo. Nesse método não é necessário o uso de chama para comprovar a formação do gás.
Na representação, um funil com água gotejando, foi preso pela rolha que veda a boca do kitassato, onde foi colocado no seu interior pedras de carbureto. Esse kitassato está ligado por uma mangueira, por onde passa o gás produzido pela reação da água com o carbureto, que chega até um tubo de ensaio, emborcado num recipiente ao lado com água, que recolhe o gás formado que ao chegar no meio líquido se apresenta na forma de pequenas bolhas subindo no interior do tubo. A água dentro e em em torno do tubo, também tem a função de impedir que o acetileno escape. Observe que a água dentro do tubo de ensaio não deve chegar até o seu (topo) fundo; deverá ficar um espaço vazio nessa parte do tubo onde o gás vai se acumulando.
O etino com nitrato de prata em solução de hidróxido de amônia produz o acetileto de prata e ácido nítrico.
Questões
Ligações e Forma Estrutural do Alcino
Para termos uma visão mais clara sobre esse fenômeno, em passo a passo, partimos da distribuição dos elétrons num átomo do carbono, da disposição desses elétrons em torno do seu núcleo e o arranjo das ligações.
Temos quatro elétrons na camada de valência do átomo, que nos alcinos a maior parte se posicionam praticamente do mesmo lado.
A Formação de Dois Orbitais Híbridos e Dois Orbitais Puros
Na formação da estrutura molecular dos alcinos, é necessário ocorrer a hibridação sp2 e a formação de dois orbitais “p” puro no átomo de carbono, para que ocorra a ligação entre eles.
O Carbono Hibridizado
No carbono hibridizado o orbital "2s" se alonga e um orbital “p” puro, se retrai formando a configuração sp2 observada. Um dos orbitais "p" puro se retrai formando também outro orbital sp2.
Observando a formação do etino, quando dois átomos de carbono se aproximam e finalmente temos o seguinte arranjo:
Os orbitais “p” puro se ligam por ligações pi (π), enquanto que as ligações “sp2” se ligam por ligação sigma. Podemos notar também, que hidrogênios se aproximam e se ligam por ligações sigma.
Alcinos Verdadeiros e Falsos
Os alcinos falsos não possuem hidrogênios (H) ligados no carbono com tripla ligação.
A Nomenclatura Dos Alcinos
A Nomenclatura Dos Alcinos segue ás regras da IUPAC International Union of Pure and Applied Chemistry.
A Nomenclatura Dos Alcinos segue ás regras da IUPAC International Union of Pure and Applied Chemistry.
A nomenclatura dos alcinos é similar à dos alcenos. Segue-se a regra geral, numera-se a cadeia carbônica a partir da extremidade mais próxima da tripa ligação.
Vejamos exemplos:
Etino
2 carbonos na cadeia recebe o prefixo de “et”, o número do carbono em que está a tripla ligação e finalmente a terminação “ino”, etino IUPAC.
Propino
3 carbonos na cadeia recebe o prefixo de “prop”, o número do carbono em que está a tripla ligação e finalmente a terminação “ino”, propino IUPAC.
5 carbonos na cadeia recebe o prefixo de “pent”, o número do carbono em que está a tripla ligação e finalmente a terminação “ino”, IUPAC pent-1-ino.
Conserva-se os mesmos nomes dos radicais para alcanos, alcenos e alcadienos.
Metil – radical com 1 carbono.
Etil – radical com 2 carbonos.
Propil – radical com 3 carbonos.
Butil – radical com 4 carbonos.
A cadeia principal é a mais longa e a que contém a tripla ligação.
Conserva-se a numeração dos carbonos a partir da ligação tripla mais próxima de uma das extremidades da cadeia carbônica.
Dá-se o nome primeiro dos radicais e depois o número do carbono em que está a tripla ligação e finalmente o número de carbonos da cadeia.
Observemos alguns exemplos:
4-metil-pentino
O radical metil está no carbono 4, a tripla ligação está no carbono 2, e o número da carbonos na cadeia principal é 5 a nomenclatura segundo a IUPAC é 4-metil-pent-2-ino
Observemos alguns exemplos:
4-metil-pentino
O radical metil está no carbono 4, a tripla ligação está no carbono 2, e o número da carbonos na cadeia principal é 5 a nomenclatura segundo a IUPAC é 4-metil-pent-2-ino
Mudando a tripla ligação para o carbono 1, o mesmo alcino fica sendo chamado de: 4-metil-pent-1-ino IUPAC.
Outro exemplo: 2-metil-hex-3-ino IUPAC.
3-metil-pent-1-ino IUPAC
3,3-dimetil-but-1-ino IUPAC
2,2-dimetil-hept-3-ino IUPAC
Isomeria Dos Alcinos
Isomeria com Ciclenos
Os alcinos com 3 ou mais carbonos na cadeia são isômeros dos ciclenos. A primeira molécula é o prop-1-ino, a segunda molécula é o ciclo-propeno.
Prop-1-ino Ciclo- propeno
Isômero de Posição
Nos isômeros de posição, as moléculas envolvidas apresentam mudança de posição da tripla ligação. Na primeira molécula a tripla ligação está no carbono 1 (but-1-ino) e na segunda molécula a tripla ligação está no carbono 2, (but-2-ino).
Reações Dos Alcinos
Reações de polimerização – Polimerização Acíclica ou Linear
Montagem de um Dímero
Na montagem dois monômeros de acetilenos reagem e se transformam no dímero vinilacetileno.
Dois acetilenos Vinilacetileno - é um dímero
Montagem de um Trímero
Na montagem do trímero, três acetilenos reagem e se transformam no divinilacetileno.
Na montagem do trímero, três acetilenos reagem e se transformam no divinilacetileno.
Três acetilenos Divinilacetileno - (trímero)
Reação de Formação do Benzeno – Polimerização Cíclica
Na formação do benzeno três acetilenos formam o anel benzênico.
Reação Para Obtenção Industrial do Acetileno
1º passo – Obtenção da cal viva
Aquece-se o calcário (CaCO3) pela queima de carvão, que produz temperatura elevada de aproximadamente 900 ºC e obtemos a cal virgem (CaO) e gás carbônico (CO2).
2º passo – Obtenção do carbureto
Numa segunda etapa, a cal viva obtida, por ignição elétrica que alcança temperatura acima de 2000 ºC, é transformado em carbureto de cálcio (CaC2) ou pedra de carbureto. Se considerarmos que a preparação é feita por ignição elétrica, não havendo consumo de gás oxigênio e devido a escassez do oxigênio presente na cal virgem, há simplesmente a formação do gás monóxido de carbono.
3º passo – Obtenção do acetileno
Na representação, um funil com água gotejando, foi preso pela rolha que veda a boca do kitassato, onde foi colocado no seu interior pedras de carbureto. Esse kitassato está ligado por uma mangueira, por onde passa o gás produzido pela reação da água com o carbureto, que chega até um tubo de ensaio, emborcado num recipiente ao lado com água, que recolhe o gás formado que ao chegar no meio líquido se apresenta na forma de pequenas bolhas subindo no interior do tubo. A água dentro e em em torno do tubo, também tem a função de impedir que o acetileno escape. Observe que a água dentro do tubo de ensaio não deve chegar até o seu (topo) fundo; deverá ficar um espaço vazio nessa parte do tubo onde o gás vai se acumulando.
Reação de Produção de Acetona
Na produção da acetona , em primeiro lugar entra o alcino, propino, adiciona-se água a esse composto, e entra também ácido sulfúrico mais sulfato de mercúrio, a transformação produz um enol, que sendo instável sofre um rearranjo do seus hidrogênios e por fim produz a acetona. Observe que a acetona formada pode reverter no enol e vice-versa.
Na reação, adiciona-se o haleto cloro ao alcino, que ao reagir produz o di-haleto di-cloro-eteno. Continuando a reação, ao adicionar novamente cloro há a formação do tetra-cloro-etano.
Reação de Produção de Acrilonitrila
Na reação, o etino interage com o ácido cianídrico produzindo o monômero de acrilonitrila ,que polimerizado n. vezes, produz a poliacrilonitrila com a qual se produz fibras sintéticas utilizadas na confecção de malhas para blusas de frio, muito utilizadas no inverno.
Muitos monômeros de acrilonitrila se unem e formam a poliacrilonitrila.
Reação de Produção de Acetiletos
O etino com nitrato de prata em solução de hidróxido de amônia produz o acetileto de prata e ácido nítrico.
É conveniente salientar que o composto acetileto de prata é tóxico, também explosivo no calor de uma chama, ou em alta temperatura de um modo geral e ainda é sensível a choques violentos.
Questões
1) Assinale somente a alternativa correta. Na definição dos alcinos podemos dizer que são hidrocarbonetos ou substâncias que tem em suas estruturas moleculares representativas:
a) uma única dupla ligação entre carbonos da cadeia principal.
b) uma única ligação simples entre carbonos da cadeia principal.
c) uma única tripla ligação entre carbonos da cadeia principal.
d) duas duplas ligações entre carbonos da cadeia principal.
e) várias duplas ligações entre carbonos da cadeia principal.
2) Quanto a solubilidade, podemos dizer que os alcinos são quase insolúveis em_____ que 1 litro dilui apenas 1 litro de acetileno, mas um ótimo solvente é a________que 1 litro dilui 300 litros de acetileno.
a) álcool metanol e álcool etanol.
b) água e acetona.
c) ácido sulfúrico ácido acético.
d) hidróxido de potássio carbonato de cálcio.
e) água e benzeno.
3) Das moléculas apresentadas abaixo é um alcino somente:
a) ( ) b) ( ) c) ( ) d) ( ) e) ( )
4) Assinale somente a alternativa correta.
Na produção do plástico P.V.A, primeiramente o acetileno é transformado ______ e posteriormente o acetato de vinila é transformado em _______ .
b) orlon, acrilonitrila.
c) acetato de vinila, poliacetato de vinila.
d) acetaldeido, ácido acético.
e) cloreto de vinila, policloreto de vinila.
5) Assinale somente a alternativa correta.
Para se produzir acetona, primeiramente o acetileno é transformado em _______, o acetaldeido é transformado em _______, posteriormente o ácido acético sofre modificação para ________.
Para se produzir acetona, primeiramente o acetileno é transformado em _______, o acetaldeido é transformado em _______, posteriormente o ácido acético sofre modificação para ________.
b) Alileno, di-cloro-eteno, acetona.
c) etanol, acetato de vinila, Vinilacetileno.
d) acetaldeido, ácido acético, acetona.
e) carbureto, acetona, poliacrilonitrila.
6) O nome químico da molécula a seguir é:
a) but-1-ino.
b) pent-2-ino.
c) pent-1-ino.
d) propino.
e) 3,3-dimetil-but-1-ino.
7) O alcino apresenta 5 carbonos na cadeia principal e a tripla ligação está localizada no carbono 2. O nome desse alcino é:
a) prop-1-ino.
b) hex-2-ino.
c) but-2-ino.
d) pent-2-ino.
e) 2-metil-pent-3-ino
8) Dada a seguinte estrutura molecular a seguir:
O nome desse composto químico é:
a) 3,3-dimetil-but-1-ino.
b) 2,2-dimetil-hept-3-ino.
c) 3,3-dimetil-but-1-ino.
d) 3-metil-pent-1-ino.
e) 4-metil-pent-1-ino.
9) Observe as moléculas dos alcinos abaixo:
a) tautômero e isômero.
b) dímeros de posição.
c) isômero e elastomero.
d) polímeros sintéticos.
e) isômeros de posição.
10) A estrutura abaixo representa um polímero com o qual se produz um plástico usado na confecção de fibras têxteis felpudas, o orlon o crylon com o qual se fabrica cobertores, mantas, tapetes, carpetes e bichos de pelúcia.
Essa estrutura é a representação:
a) do poliacetato de vinila.
b) da poliacrilonitrila (PAN).
c) do poliestireno (PE).
d) do 4-metil-octadieno-2,5.
e) da 3-etil-4-metil-2-pentanona.
9) Observe as moléculas dos alcinos abaixo:
As duas moléculas possuem o mesmo número de elementos químicos a mesma massa a mesma tripla ligação, mas presentam uma funcionalidade diferente. Essas moléculas são:
b) dímeros de posição.
c) isômero e elastomero.
d) polímeros sintéticos.
e) isômeros de posição.
10) A estrutura abaixo representa um polímero com o qual se produz um plástico usado na confecção de fibras têxteis felpudas, o orlon o crylon com o qual se fabrica cobertores, mantas, tapetes, carpetes e bichos de pelúcia.
Essa estrutura é a representação:
a) do poliacetato de vinila.
b) da poliacrilonitrila (PAN).
c) do poliestireno (PE).
d) do 4-metil-octadieno-2,5.
e) da 3-etil-4-metil-2-pentanona.
Bibliografia
Química - Química Orgânica - Ricardo Feltre. Editora Moderna, 2007. Volume 3, p. 54 a 57, 224 a 238. 6a edição, 2004.
Acrilonitrila - Cetesb
www.cetesb.sp.gv.br/userfiles/file/fitlaboratórios/fit/acrilonitrila.pdf.
Poliacrilonitrila termoplástica - Um novo materialde ... - Quimlab
www.quimlab.com.br/docsartigo_poliacrilonitrila_termoplástica.pdf
João Usberco,Edgard Salvador. Química volume Único. 5ª Edição reformulada 2002, 2ª tiragem 2003. Editora Saraiva, São Paulo 2002.
Química - Química Orgânica - Ricardo Feltre. Editora Moderna, 2007. Volume 3, p. 54 a 57, 224 a 238. 6a edição, 2004.
Acrilonitrila - Cetesb
www.cetesb.sp.gv.br/userfiles/file/fitlaboratórios/fit/acrilonitrila.pdf.
Poliacrilonitrila termoplástica - Um novo materialde ... - Quimlab
www.quimlab.com.br/docsartigo_poliacrilonitrila_termoplástica.pdf
João Usberco,Edgard Salvador. Química volume Único. 5ª Edição reformulada 2002, 2ª tiragem 2003. Editora Saraiva, São Paulo 2002.
Lia Monguilhot Bezerra, Julio Cezar Foschini Lisboa, Aline Thaís Bruni, Ana luiza Petilo Nery, Paulo A. G. Bianco, Rodrigo Marchiori Liegel Simone Garcia de Ávila, Simone Jaconetti Ydi, Solange Wagner Locatelli, Vera Lucia Mitiko Aoki. Ser Protagonista. Química 3, Ensino Médio Edições SM, 3ª Edição São Paulo 2016.
Martha Reis. Química 3. Química - Ensino Médio PNLD 2018, 2019, 2020, Editora Ática 2ª Edição São Paulo 2016.
Victor A. Nehmi. Química 2º Grau. Volume único Editora Ática São Paulo 1995.
João Usberco, Edgard Salvador. Química; Química Orgânica, Volume 3, 2ª Edição Editora Saraiva São Paulo 1996.
Francisco Miragaia Peruzzo, Eduardo Leite do Canto. Química na Abordagem do Cotidiano Volume 3. Editora Moderna, 4ª Edição São paulo 2010.
Eduardo Roberto da Silva, Olímpio Salgado Nóbrega, Ruth Hashimoto da Silva. Química Transformações e Aplicações. Editora Ática, 1ª Edição, São Paulo 2001.
WildsonLuiz Pereira dos Santos, Gerson de Souza Mól, Roseli Takako Matsunaga, Siland Meiry França Dib, Eliana Nilvana F. de Castro, Gentil de Souza Silva, Sandra maria de Oliveira Santos, Salvia Barbosa Farias. Pequis - Química e Sociedade. Volume Único Ensino Médio, 1ª edição São Paulo 2008.
Eduardo Fleury Mortimer, Andrea Hota Machado - Química Volume 3. Química Ensino Médio Editora Scipione 3ª Edição São Paulo 2017.
Martha Reis marques da Fonseca. Química - Volume 3, Meio Ambiente, cidadania, Tecnologia. Editora FTD 1ª Edição São paulo 2010.






















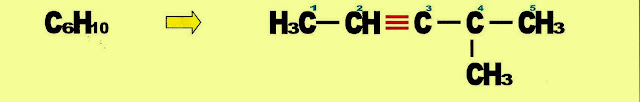























Digite seu comentário...gostei do conteudo
ResponderExcluir