Fenóis
Definição:
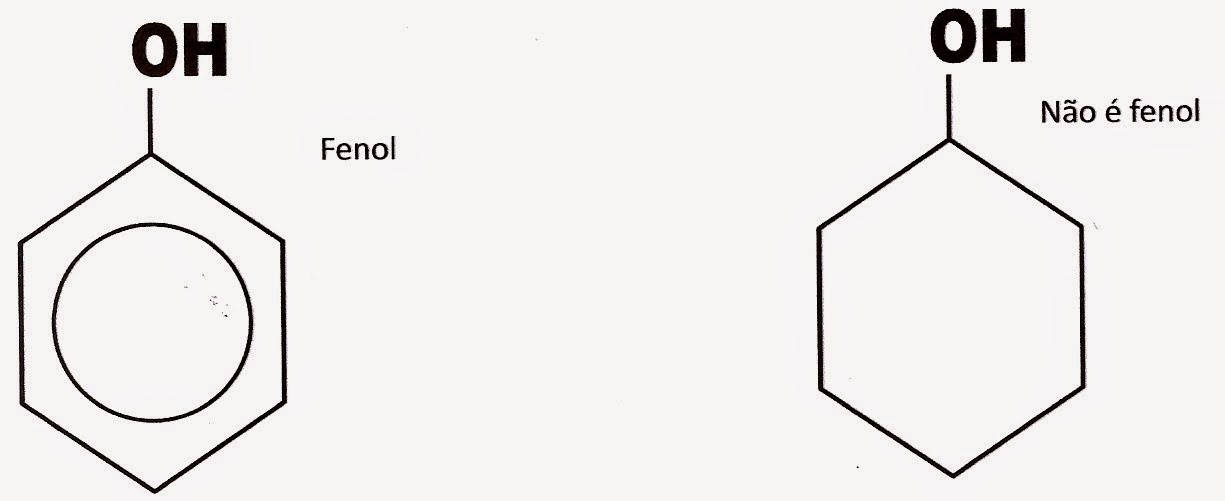
Veja exemplo de um fenol e um não fenol.
Classificação
Os fenóis podem ser classificados como monofenóis, difenóis, trifenóis etc.
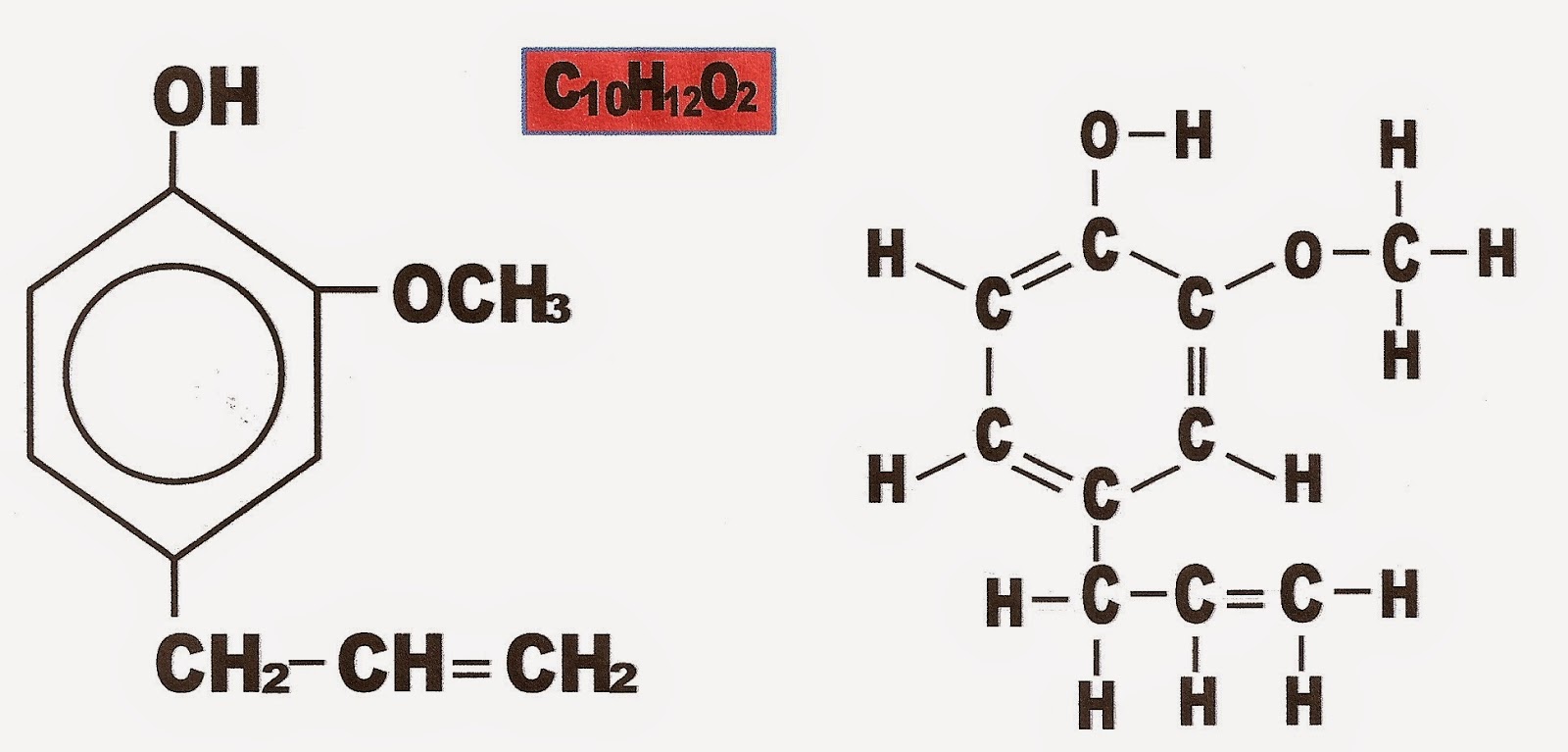
Exemplos De Alguns Fenóis
Fenol benzeno ou hidróxi-benzeno. É o fenol mais simples de todos.
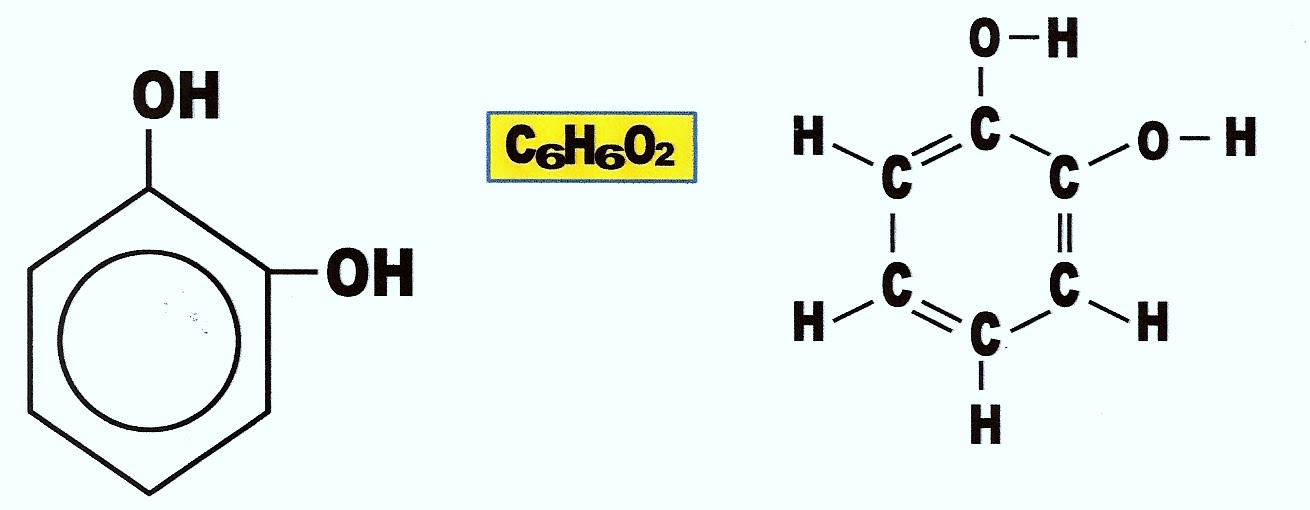
Orto-hidroquinona ou difenol ou ainda benzeno-1,2-diol
Orto-hidroquinona ou 1,2-difenol-benzeno, é solúvel em água.1,3 dihidroxi-benzeno ou Resorcinol
1-hidróxi-2-metil-benzeno

1-hidróxi-2-metil-benzeno
1-hidroxi-naftaleno ou α-naftol
 |
| 1-hidroxi-naftaleno ou alfa naftol |
Acetaminofen - analgésico
Polímero de Novolac, tinta epóxi.
O novolac como resina é utilizada na proteção de ferragens e concreto. Como resina o novolac é utilizado na produção de vidros para aumentar a sua resistência á temperatura.
Utilidade Dos Fenóis
A Utilidade do Fenol Benzeno
O Fenol benzeno é utilizado como desinfetante creolina,
nos ferimentos de animais, pode atuar na coagulação de proteínas de
microrganismos decompositores, causadores de mau cheiro. Na estética é
utilizado para fazer peeling e evitar enrugamento
da pele, no método, pode ser possível fazer a substância atuar nas células mortas até das camadas mais profundas da pele remove-las. Na preservação de madeiras contra ataques de fungos e besouros, na
industria química é utilizado na fabricação de plásticos ou resinas e polímeros
da baquelite ou fórmica. Tem a
sua aplicação na industria de perfumes, de corantes, e ainda na preparação do
ácido pícrico que é utilizado na fabricação de explosivos, na produção de
vernizes, desodorantes, adesivos, cosméticos, tintas, é ainda utilizado na
industria farmacêutica na preparação de medicamentos e também da aspirina, é
usado na produção de fios têxteis de poliamida ou nylon.
Orto-hidroquinona ou 1,2-difenol-benzeno
É utilizado na composição de creme dermatológico para clareamento da pele, nas manchas escuras, nas sardas, melanoses provocadas pela incidência da luz solar, na hiperpigmentação pelo excesso de melanina.
Tem a sua utilidade como revelador fotográfico, atuando sobre os haletos de prata.
Nomenclatura dos Fenóis
Nome químico: hidroxibenzeno
Nomes genéricos: fenol, ácido fênico.
Orto-hidroquinona ou 1,2-difenol-benzeno
É utilizado na composição de creme dermatológico para clareamento da pele, nas manchas escuras, nas sardas, melanoses provocadas pela incidência da luz solar, na hiperpigmentação pelo excesso de melanina.
Tem a sua utilidade como revelador fotográfico, atuando sobre os haletos de prata.
Nomenclatura dos Fenóis
Nome químico: hidroxibenzeno
Nomes genéricos: fenol, ácido fênico.
Reações Dos Fenóis
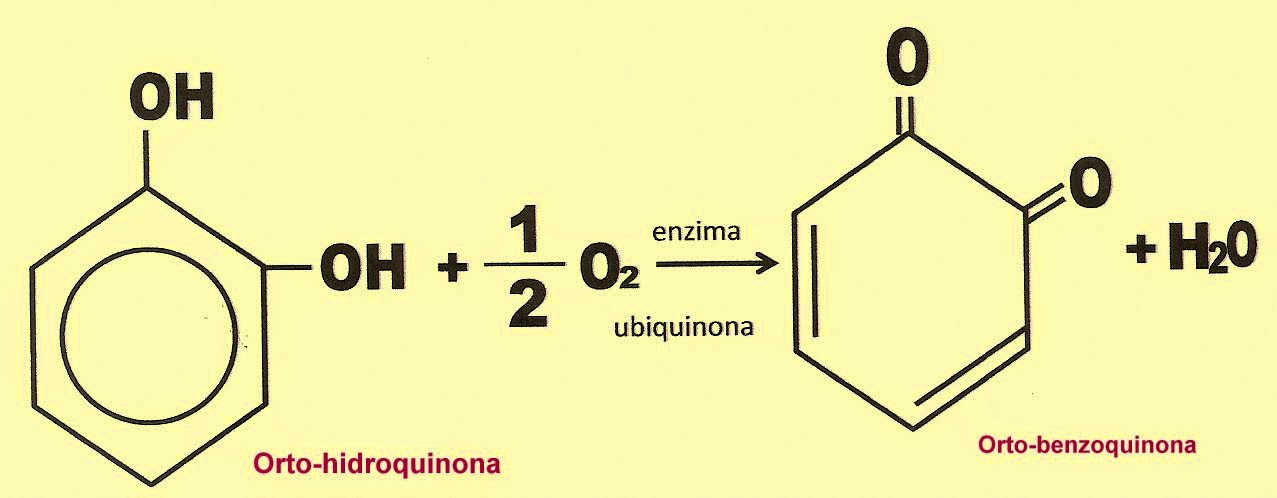
Reação de Transformação da Orto-hidroquinona em Orto-benzoquinona.
Algumas frutas como a maçã, pera, banana, quando estamos
comendo uma parte e deixamos o restante
ao ar livre, depois de algum tempo, quando voltamos, encontramos a
sua polpa escurecida. Esse fenômeno se dá pela presença da hidroquinona de cor clara que se
transforma em orto-benzoquinona de cor escura, quando exposto ao ar livre.
Essa reação é de oxidação ou desidrogenação pela ação de uma
enzima chamada de ubiquinona ou Coenzima Q10, a qual está presente em praticamente em todas células, tanto animal como vegetal. A
transformação se dá da seguinte forma: pela ação dessa enzima, ocorre a
retirada de dois elétrons e dois prótons da molécula da hidroquinona transformando-a em o-benzoquinona.
A orto-benzoquinona não é fenol é uma diacetona.
Química. Ricardo Feltre, Química Orgânica, vol. 3, Editora Moderna, 6º edição, São Paulo 2004.
Francisco Miragaia Peruzzo, Eduardo Leite do Canto. Química na Abordagem do Cotidiano, Química Orgânica, vol. 3. Editora Moderna, 4º edição, São Paulo 2010.
Fenol - Wikipédia, a Enciclopédia livre.
Cresol - Wikipédia, a enciclopédia livre
pt.wikipedia.org/wiki/cresol
pt.wikipedia.org/wiki/feno
Cresol (O-cresol, m- cresol e p-cresol) - Cetesb
www.cetesb.sp.gov.br/userfiles/laboratorios/fit/cresol.pdf
www.cetesb.sp.gov.br/userfiles/laboratorios/fit/cresol.pdf