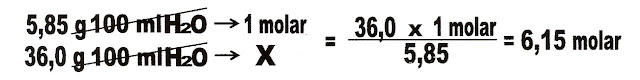Soluções
Soluções Definição
Uma solução, mesmo contendo vários solutos diluídos, deve se apresentar transparente ao ser examinada contra a luz, e deve estar sem nenhuma turvação bolhas ou partículas suspensas no meio.
A quantidade do soluto presente na solução ultrapassou o limite de sua dissolução então
sobra soluto sem diluir no fundo do recipiente. Exemplo quando adoçamos exageradamente o nosso cafezinho que fica melado e sobra açúcar no fundo da xícara.
Soluções Gasosas
São misturas gasosas são geralmente imperceptíveis pela nossa visão a olho nu. Temos como exemplo o ar da atmosfera que nos envolve é uma solução gasosa contendo vários gases diferentes. Gás nitrogênio (N2), gás oxigênio (O2), gás argônio (Ar), gás carbônico (CO2), gás ozônio (O3)
Soluções Líquidas
A água do mar é uma solução líquida contendo vários gases e sais dissolvidos na sua composição.
A água mineral engarrafada é uma solução muito diluída contendo vários gases e sais minerais dissolvidos na sua composição.
A água potável é uma solução.
A cerveja é uma solução.
Os refrigerantes gaseificados comerciais engarrafados são soluções.
O café coado que tomamos todos os dias é uma solução.
O soro fisiológico de uso hospitalar é uma solução.
O soro glicosado de uso hospitalar é uma solução.
O álcool etílico 42% é uma solução 42% etanol e 58% água.
Composição da Água Mineral Comercial
A água mineral pode variar a sua composição de fonte para fonte, portanto para se ter uma ideia dos compostos presentes em cada tipo de água, de-se ler o rótulo da embalagem que a contém o qual deverá apresentar seus valores. Por exemplo; uma água mineral poderá conter:
fluoreto de sódio 0,52 mg/litro
cloreto de sódio 11,62 mg/litro
bicarbonato de sódio 37,4 mg/litro
bicarbonato de potássio 6,40 mg/litro
sulfato de estrôncio 2,25 mg/litro
sulfato de cálcio 15,84 mg/litro.
bicarbonato de cálcio 102,72 mg/litro.
bicarbonato de magnésio 36,52 mg/litro.
óxido de zinco 0,01 mg/litro.
fluoreto de lítio 0,08 mg/litro
Para resolver as alternativas do exercício 1, basta multiplicar cada um dos valores por mil ou simplesmente deslocar a virgula três casas para a direita.
3) Deseja-se saber o pH de uma solução em que foi juntado 200 mL de NaOH 0,2 molar, com 200 mL de H2SO4 0,2 molar. Se ao juntar as duas partes a solução não foi neutralizada totalmente, qual é a molaridade da solução final.
Soluções diluídas
A quantidade de soluto dissolvido é pequena. Exemplo os sais presentes na água mineral que tomamos.
Uma solução de hidróxido de sódio NaOH) 0,02 molar é uma solução diluída.
Uma solução de ácido clorídrico (0,01) molar é uma solução diluída.
Exemplos de Algumas Soluções
Solução de ácido bórico H3BO3.
Quando seco é um Cristal sólido pó incolor ou branco - o solvente é a água, 100 mL de água dissolve 5,14 g desse ácido.
Solução de bicromato de potássio K2Cr2O7 apresenta-se sólido, na forma de cristal - solvente água, dissolve-se 147 g dessa substância em água e completa-se para um litro. Para vários usos, determinação quantitativa de molibdênio, ou para lavagem de instrumentos que se exige certa assepsia, também é utilizado na determinação quantitativa de glicerina.
Soluções Concentradas
O soluto está dissolvido completamente até o seu limite máximo de dissolução no solvente.
Uma solução de hidróxido de sódio (NaOH) 4 molar é uma solução concentrada.
Uma solução de ácido clorídrico (HCl) 4 molar é uma solução concentrada.
Exemplo.
1) O cloreto de sódio (NaCl), a 25 ºC e 1 uma atmosfera de pressão, dilui até 36 gramas em 100 mL de solução. Pede-se preparar uma solução com 50 mL de solvente e 20 gramas de soluto e dizer se forma corpo de fundo e se a solução preparada é concentrada ou saturada.
Resolução
Soluções Saturadas
A quantidade de soluto dissolvido é pequena. Exemplo os sais presentes na água mineral que tomamos.
Uma solução de hidróxido de sódio NaOH) 0,02 molar é uma solução diluída.
Uma solução de ácido clorídrico (0,01) molar é uma solução diluída.
Exemplos de Algumas Soluções
Solução de ácido bórico H3BO3.
Quando seco é um Cristal sólido pó incolor ou branco - o solvente é a água, 100 mL de água dissolve 5,14 g desse ácido.
Solução de bicromato de potássio K2Cr2O7 apresenta-se sólido, na forma de cristal - solvente água, dissolve-se 147 g dessa substância em água e completa-se para um litro. Para vários usos, determinação quantitativa de molibdênio, ou para lavagem de instrumentos que se exige certa assepsia, também é utilizado na determinação quantitativa de glicerina.
Soluções Concentradas
O soluto está dissolvido completamente até o seu limite máximo de dissolução no solvente.
Uma solução de hidróxido de sódio (NaOH) 4 molar é uma solução concentrada.
Uma solução de ácido clorídrico (HCl) 4 molar é uma solução concentrada.
Exemplo.
1) O cloreto de sódio (NaCl), a 25 ºC e 1 uma atmosfera de pressão, dilui até 36 gramas em 100 mL de solução. Pede-se preparar uma solução com 50 mL de solvente e 20 gramas de soluto e dizer se forma corpo de fundo e se a solução preparada é concentrada ou saturada.
Resolução
Como foi utilizado 20 gramas de soluto para a solução,
sobra 2 gramas de soluto sem ser dissolvido. Resposta. Sim sobra corpo de
fundo.
Como forma corpo de fundo a solução é saturada.
Soluções Saturadas
A quantidade do soluto presente na solução ultrapassou o limite de sua dissolução então
sobra soluto sem diluir no fundo do recipiente. Exemplo quando adoçamos exageradamente o nosso cafezinho que fica melado e sobra açúcar no fundo da xícara.
Soluções Gasosas
São misturas gasosas são geralmente imperceptíveis pela nossa visão a olho nu. Temos como exemplo o ar da atmosfera que nos envolve é uma solução gasosa contendo vários gases diferentes. Gás nitrogênio (N2), gás oxigênio (O2), gás argônio (Ar), gás carbônico (CO2), gás ozônio (O3)
Soluções Líquidas
A água do mar é uma solução líquida contendo vários gases e sais dissolvidos na sua composição.
A água mineral engarrafada é uma solução muito diluída contendo vários gases e sais minerais dissolvidos na sua composição.
A água potável é uma solução.
A cerveja é uma solução.
Os refrigerantes gaseificados comerciais engarrafados são soluções.
O café coado que tomamos todos os dias é uma solução.
O soro fisiológico de uso hospitalar é uma solução.
O soro glicosado de uso hospitalar é uma solução.
O álcool etílico 42% é uma solução 42% etanol e 58% água.
Composição da Água Mineral Comercial
A água mineral pode variar a sua composição de fonte para fonte, portanto para se ter uma ideia dos compostos presentes em cada tipo de água, de-se ler o rótulo da embalagem que a contém o qual deverá apresentar seus valores. Por exemplo; uma água mineral poderá conter:
fluoreto de sódio 0,52 mg/litro
cloreto de sódio 11,62 mg/litro
bicarbonato de sódio 37,4 mg/litro
bicarbonato de potássio 6,40 mg/litro
sulfato de estrôncio 2,25 mg/litro
sulfato de cálcio 15,84 mg/litro.
bicarbonato de cálcio 102,72 mg/litro.
bicarbonato de magnésio 36,52 mg/litro.
óxido de zinco 0,01 mg/litro.
fluoreto de lítio 0,08 mg/litro
Soluções
Sólidas
Geralmente são misturas salinas anidra como cloreto de sódio com iodeto de potássio e por outro lado comumente as ligas metálicas.
Liga
metálica de cobre (Cu) e níquel (Ni) é uma solução
O
elemento químico níquel tem
densidade de 8,9 g/Cm3,
ponto de fusão de 1455oC e
ponto de ebulição 2913 oC.
O cobre
tem o ponto de fusão 1084OC, ponto
de ebulição 2567OC
e densidade de 8,92 g/cm3.O
níquel é muito solúvel no cobre por isso
facilmente pode ser transformado em liga.
A Liga metálica de cobre (Cu) e níquel (Ni)
se apresenta em diversas porcentagens de
acordo com a necessidade
de resistência da peça a ser produzida,
por exemplo; fabrica-se a liga com 95 % de cobre e 5% de níquel,
com 90 % cobre 10 % níquel, ou a
liga de 70% de cobre e 30% níquel.
Outras ligas possuem também um pouco de ferro e manganês. Essas ligas; precisamente a com 5% de níquel é utilizada na fabricação de motores de veículos marítimos pois é resistente a corrosão pela umidade, sal marinho e também a ácidos. Outra liga pode atingir 65% de níquel e 34 % cobre com um pouco de ferro e manganês incluso nessa solução, outras ligas 55 % de níquel e 44% de cobre, com ferro e manganês. A liga com 20 % de níquel 80 % cobre tem sua aplicação na fabricação de lâminas de turbinas, chapas e tiras, resistores elétricos , recipientes de transistores, guias de ondas de radar, aquecedores de água doméstico, moedas e medalhas cunhadas. A mistura 95 % cobre e 5% níquel é utilizado na fabricação de chapas placas e tubos que são destinadas para tubos condutores de água salgada e também em anéis de mangueiras de Bombeiros.
Outras ligas possuem também um pouco de ferro e manganês. Essas ligas; precisamente a com 5% de níquel é utilizada na fabricação de motores de veículos marítimos pois é resistente a corrosão pela umidade, sal marinho e também a ácidos. Outra liga pode atingir 65% de níquel e 34 % cobre com um pouco de ferro e manganês incluso nessa solução, outras ligas 55 % de níquel e 44% de cobre, com ferro e manganês. A liga com 20 % de níquel 80 % cobre tem sua aplicação na fabricação de lâminas de turbinas, chapas e tiras, resistores elétricos , recipientes de transistores, guias de ondas de radar, aquecedores de água doméstico, moedas e medalhas cunhadas. A mistura 95 % cobre e 5% níquel é utilizado na fabricação de chapas placas e tubos que são destinadas para tubos condutores de água salgada e também em anéis de mangueiras de Bombeiros.
Exercícios
Alguns Valores de medidas de uso em Laboratórios.
A molaridade da solução do ácido cloridrico comercial é de 12 molar.
Preparo de soluções
2) Transformar os seguintes valores de litro para mililitros
2) Transformar os seguintes valores de litro para mililitros
a)
|
0,01 L
|
10 mL
|
j)
|
0,91 L
|
910 mL |
b)
|
0,018 L
|
k)
|
1,05 L
|
||
c)
|
0,02 L
|
l)
|
1,15 L
|
||
d)
|
0,025 L
|
m)
|
1,19 L
|
||
e)
|
0,093 L
|
n)
|
1,25 L
|
||
f)
|
0,155 L
|
O)
|
1,51 L
|
||
g)
|
0,200 L
|
p)
|
2,09 L
|
||
h)
|
0,23 L
|
q)
|
2,26 L
|
||
i)
|
0,551 L
|
r)
|
2,451 L
|
||
j)
|
0,75 L
|
s)
|
2,55 L
|
Para resolver as alternativas do exercício 1, basta multiplicar cada um dos valores por mil ou simplesmente deslocar a virgula três casas para a direita.
3)
Quanto do soluto de cloreto de sódio (NaCl)
em grama (s) devo pesar numa balança analítica para preparar 100 mL de solução fisiológica 0,9%?
Questões Sobre Soluções
1) Sabendo que 1 molar de ácido clorídrico
neutraliza 1 molar
de
hidróxido de sódio,
numa titulação
ácido-base, foi colocado num erlenmayer 50.0 mL de hidróxido de sódio de concentração 0,2 molar.
Quanto mL de
ácido clorídrico 1,0 molar, você deverá titular sobre a solução de soda caustica do erlenmeyer para neutraliza-lo?

2) 250 mL de hidróxido de sódio (NaOH) 0,01 molar precisa ser neutralizado pelo ácido sulfúrico (H2SO4). Pergunta-se: quantas gramas desse ácido serão necessárias para a neutralização total da base?
Resolução.

2) 250 mL de hidróxido de sódio (NaOH) 0,01 molar precisa ser neutralizado pelo ácido sulfúrico (H2SO4). Pergunta-se: quantas gramas desse ácido serão necessárias para a neutralização total da base?
Resolução.
3) Deseja-se saber o pH de uma solução em que foi juntado 200 mL de NaOH 0,2 molar, com 200 mL de H2SO4 0,2 molar. Se ao juntar as duas partes a solução não foi neutralizada totalmente, qual é a molaridade da solução final.
A reação pode ser representada pela equação:
Ou ainda pelo esquema:
Achar a massa gasta do hidróxido de sódio (NaOH) em 1 litro de solução.
Achar a massa do ácido sulfúrico (H2SO4) em 1 litro de solução.
Achar a massa do hidróxido de sódio em 200 mL de solução.
Sobra do ácido que não reagiu com o hidróxido de sódio. A solução é ácida.
Achar a massa gasta do hidróxido de sódio (NaOH) em 1 litro de solução.
Achar a massa do ácido sulfúrico (H2SO4) em 1 litro de solução.
Achar a massa do hidróxido de sódio em 200 mL de solução.
Achar a massa do ácido sulfúrico em 200 mL de solução.
Sobra do ácido que não reagiu com o hidróxido de sódio. A solução é ácida.
Como duplicou o volume da solução, que de 200 mL foi para 400 mL, a molaridade final: será:
5) ( Fuvest – SP) Um analgésico
em gotas deve ser ministrado na quantidade de 3,0 mg por quilograma de
peso corporal, não podendo contudo exceder 200 mg por dose. Cada gota contém 5,0 mg de analgésico.
Quantas gotas deverão ser administradas a um paciente de 80,0 kg? Indique seu
raciocínio.
Observe que o indivíduo não pode tomar mais que 200.0 mg do analgésico
Se necessita tomar 200 mg do medicamento, quantas gotas o indivíduo terá que tomar?
6) Foi aplicado no Enem e na UFRJ. No cultivo hidropônico de hortaliças, as plantas não são cultivadas diretamente no solo. Uma solução contendo nutrientes circula entre as raízes. A tabela a seguir apresenta a composição recomendada de alguns nutrientes para o cultivo hidropônico do alface.
No cultivo hidropônico de hortaliças, as plantas não são cultivadas diretamente no solo. Uma solução contendo nutrientes circula entre as raízes. A tabela a seguir apresenta a composição recomendada de alguns nutrientes para o cultivo hidropônico do alface.
Tabela
Calculando a molaridade da solução.
10) (adaptado) Sabe-se que o ácido fosfórico também faz parte da nossa dieta alimentar. Quando ingerido é digerido no estômago e absorvido pelo organismo na forma de fósforo. 1 L de refrigerante coca-cola contém 0.6 g de ácido fosfórico. Sabendo que uma pessoa pode tomar até 5 mg/kg de seu peso corporal, um indivíduo de 42 kg pode tomar quantas latinhas de 350 mL por dia? Assinale a alternativa correta.
Raciocínio lógico.
4) O
ácido bórico pode ser usado como adubo foliar para as plantas na
concentração de 0,3%.
Um agricultor com a intenção de aumentar a produção,
necessita preparar
10
000 L da solução de ácido bórico para ser usado na sua plantação de café.
Quanto de ácido bórico o produtor precisará comprar para preparar a solução
para o seu cafezal?
a) 3 000 Kg.
b) 620 kg.
c) 60 kg.
d) 300 kg.
e) 30 kg.
Resolução.
Resolução do problema utilizando regra de três.
Observe que o indivíduo não pode tomar mais que 200.0 mg do analgésico
Se necessita tomar 200 mg do medicamento, quantas gotas o indivíduo terá que tomar?
6) Foi aplicado no Enem e na UFRJ. No cultivo hidropônico de hortaliças, as plantas não são cultivadas diretamente no solo. Uma solução contendo nutrientes circula entre as raízes. A tabela a seguir apresenta a composição recomendada de alguns nutrientes para o cultivo hidropônico do alface.
No cultivo hidropônico de hortaliças, as plantas não são cultivadas diretamente no solo. Uma solução contendo nutrientes circula entre as raízes. A tabela a seguir apresenta a composição recomendada de alguns nutrientes para o cultivo hidropônico do alface.
Tabela
Nutrientes
|
Concentração mg/L
|
K - potássio
|
312
|
Mg - Magnésio
|
48
|
S - enxofre
|
?
|
Foram utilizados
sulfato de potássio (K2SO4) e
o sulfato de magnésio (MgSO4) para
preparar uma solução nutriente de acordo com as concentrações apresentadas na
tabela.
Não tendo a concentração de enxofre, na tabela, pergunta-se: a concentração em mg/L de enxofre nesta solução será igual a.
Dados
a massas molares:
Mg = 24 g/mol
K = 39 g/mol
S = 32 g/mol
Para achar a massa do enxofre gasta para preparar a solução, basta somar os 4 enxofres do composto sulfato de potássio, mais os dois enxofres do composto sulfato de magnésio = 6 x 32 = 192 g. Como a concentração no problema foi dado em miligrama por litro, basta passar automaticamente a massa de grama para miligrama.
a)
32 mg/L
b)
64 mg/L
c)
128 mg/L
d)
192 mg/L
e)
224 mg/L
7) O sal de cozinha, cloreto de sódio (NaCl) a 25 ºC e 1 atm, 36,0 gramas
dissolve totalmente em 100 mL
de água. Pede-se calcular a molaridade dessa solução.
Calculando a molaridade da solução.
Quanto de água você deve acrescentar na solução para
transforma-la em solução 1 molar?
8) Para uso de rotina num laboratório, deseja-se preparar 1
litro de solução de H2SO4, 2 molar a partir do ácido concentrado 15 mol/L. Qual
alíquota do ácido concentrado devo usar na preparação da solução?
Devo medir 133 mL
da solução concentrada de H2SO4, para preparar 1 litro de solução 2 molar.
9) Um frasco de leite de magnésia contém 350 mL da solução,
que contém 30 gramas do composto ativo Mg(OH)2. Ao tomar 2 colheres de sopa de 15 mL cada uma, quantas
miligramas do composto o indivíduo em tratamento tomou?
10) (adaptado) Sabe-se que o ácido fosfórico também faz parte da nossa dieta alimentar. Quando ingerido é digerido no estômago e absorvido pelo organismo na forma de fósforo. 1 L de refrigerante coca-cola contém 0.6 g de ácido fosfórico. Sabendo que uma pessoa pode tomar até 5 mg/kg de seu peso corporal, um indivíduo de 42 kg pode tomar quantas latinhas de 350 mL por dia? Assinale a alternativa correta.
a) 1 b) 2 c) 3 d) 4 e) 5
Calculando quantas miligramas de ácido fosfórico o indivíduo pode tomar.
Calculando quantas miligramas de ácido fosfórico tem cada latinha de refrigerante.
Calculando quantas miligramas de ácido fosfórico o indivíduo pode tomar.
O indivíduo poderá tomar apenas uma latinha por dia do refrigerante, para suprir as necessidades do ácido fosfórico.
11) (adaptado) O oxalato de cálcio (CaC2O4) está presente no espinafre, no tomate, pimentão, aspargo, folhas de chá, acelga etc. Aparece nos exames de urina I, especialmente nas urinas ácidas, também é responsável pela formação de cálculo renal. Um estudante trabalhando com 25 cm3 de uma amostra de solução com 0,2625g de oxalato de cálcio, quer saber a sua concentração comum.
11) (adaptado) O oxalato de cálcio (CaC2O4) está presente no espinafre, no tomate, pimentão, aspargo, folhas de chá, acelga etc. Aparece nos exames de urina I, especialmente nas urinas ácidas, também é responsável pela formação de cálculo renal. Um estudante trabalhando com 25 cm3 de uma amostra de solução com 0,2625g de oxalato de cálcio, quer saber a sua concentração comum.
a) 0,0105 gL b) 0,00656 gL c) 10,5 gL d) 21 gL e) 31,5gL
Resolução.
Raciocínio lógico.
14) (adaptado) Foi aplicado 1500 mL de soro fisiológico, ou solução de cloreto de sódio (NaCl) 0,9% na reposição de eletrólitos de um paciente hospitalizado. Pede-se calcular a quantidade de mol do sal aplicado nesse paciente.
a) 0,12
b) 0,23
c) 0,46
d) 1,35
e) 13,5
Questões
Resolução.
Ou podemos calcular pela fórmula padrão da concentração.
12) (adaptado da Vunesp) a
partir de uma solução de concentração 15 mol/L,
prepare 500 mL de solução aquosa de
ácido sulfúrico (H2SO4) de concentração 3 mol/L.
Raciocínio lógico.
Tomando alíquota de 100 mL do ácido, de concentração 15
molar e diluindo para 500 mL eu terei a solução 3 mol/L
.
Se
13) O ácido folínico (leucovorina) é usado no tratamento da leucemia, ou
linfomas. Também é indicado como antídoto dos efeitos tóxicos da pirimetamina. É
usado no tratamento de doenças do sistema nervoso central. O ácido folínico na
forma de folinato de
cálcio é indicado como antídoto dos efeitos tóxicos do metotrexato
(MTX) um bloqueador da síntese celular.
A dose de uso como antagonista do MTX em
dose alta de 300 mg/m2 é de 20 mg/m2 de massa corpórea. Supondo que um
indivíduo que tomou 300 mg/ m2 de
MTX via intratecal deve
ser neutralizado com leucovorina 20
mg/m2.
Dados do paciente.
Altura 1,70 m e peso 60 kg
Cálculo do Índice de Massa Corpórea.
Cálculo de quanto ele precisa tomar de leucovorina para
neutralizar o metotrexato.
Outra
maneira de chegar ao mesmo resultado.
a) 0,12
b) 0,23
c) 0,46
d) 1,35
e) 13,5
Questões
1) podemos definir uma solução, mesmo contendo vários solutos diluídos, deve se apresentar transparente ao ser examinada contra a luz e:
a) deve conter turvação bolhas ou partículas suspensas no meio.
b) não deve conter turvação, bolhas ou partículas suspensas no meio, mas deve ter sabor próprio.
c) deve estar sem nenhuma turvação, bolhas ou partículas suspensas no meio.
d) não deve estar sem nenhuma turvação, bolhas ou partículas suspensas no meio.
e) deve estar com cheiro próprio, cor, densidade e aparência característica.
2) Nas soluções diluídas acontecem características particulares próprias desses tipos de soluções que são:
a) a quantidade de soluto dissolvido é grande. Exemplo os sais presentes numa salmoura.
b) a quantidade de soluto dissolvido é pequena. Exemplo os sais presentes na água mineral que tomamos.
c) a qualidade de soluto dissolvido é inexistente. Exemplo da água destilada em laboratório.
d) a quantidade de solvente dissolvido é pequena. Exemplo os sais presentes na água do mar.
e) a quantidade de solvente dissolvido é imperceptível. Exemplo os sais presentes na água de coco.
3) Podemos definir uma solução concentrada como aquela em que:
a) o solvente não se dissolve completamente até o seu limite máximo de dissolução no soluto.
b) o soluto não está dissolvido completamente até o seu limite máximo de dissolução no solvente.
c) o solvente está dissolvido incompletamente até o seu limite mínimo de associação no soluto.
d) o soluto está dissolvido completamente até o seu limite máximo de dissolução no solvente.
e) o soluto está dissolvido completamente até o seu limite mínimo de associação no solvente.
4) Podemos definir soluções saturadas como aquelas em que a quantidade do:
a) soluto presente na solução ultrapassou o limite de sua dissolução então sobra soluto sem diluir no fundo do recipiente.
b) solvente ausente na solução ultrapassou o limite, então sobra soluto sem diluir no fundo do recipiente.
c) soluto na solução ultrapassou o limite de sua dissolução então falta soluto sem diluir no fundo do recipiente.
d) solvente na solução ultrapassou o limite de sua dissolução então falta soluto diluído no fundo do recipiente.
e) soluto na mistura heterogênea ultrapassou o limite de dissolução, sobra soluto diluído no fundo do recipiente.
5) São misturas geralmente imperceptíveis pela nossa visão a olho nu. Temos como exemplo uma solução gasosa que nos envolve na atmosfera essas misturas são:
a) gasosas e geralmente perceptíveis pela nossa visão a olho nu, exemplo; o ar da atmosfera uma solução gasosa contendo dois gases diferentes.
b) gasosas e imperceptíveis pela visão ao microscópio. Exemplo; o ar expelido pelos escapamentos dos carros.
c) gasosas e geralmente imperceptíveis pela nossa visão a olho nu, exemplo; o ar da atmosfera que nos envolve é uma solução gasosa contendo vários gases diferentes.
d) sólidas e sempre perceptíveis pela nossa visão a olho nu. Exemplo; o ar da atmosfera que nos envolve é uma solução gasosa contendo apenas um gás.
e) líquidas e geralmente imperceptíveis pela nossa visão a olho nu. Exemplo; o ar comprimido do tubo de oxigênio que é uma solução gasosa contendo dois gases diferentes.
6) É característica de uma solução líquida a:
a) água da chuva é uma solução contendo vários gases e sais dissolvidos na sua liquidez.
b) água de enxurrada é uma solução contendo várias folhas, troncos e sais dissolvidos na sua estrutura.
c) café sem coar, é uma solução contendo várias partículas e sais dissolvidos na sua formação.
d) água turva de um rio, que é uma solução contendo vários corpos e sais dissolvidos na sua composição.
e) água do mar é uma solução contendo vários gases e sais dissolvidos na sua composição.
7) Geralmente são misturas sólidas as:
a) ácidas, como cloreto de sódio com cloreto de potássio e por outro lado comumente as ligas comuns.
b) salinas anidra, como cloreto de sódio com iodeto de potássio e por outro lado comumente as ligas metálicas.
c) básicas anidra, como cloreto de sódio e bicarbonato de sódio e por outro lado comumente as ligas.
d) salinas, como cloreto de sódio com iodeto de potássio e por outro lado comumente as ligas metálicas.
e) salinas, como hidróxido de sódio com cloreto de cálcio e por outro lado comumente as ligas de cristais.
8) A Liga metálica de cobre (Cu) e níquel (Ni) é uma:
a) solução gasosa.
b) solução líquida.
c) solução sólida.
d) mistura heterogênea.
e) mistura heterogênea sólida.
9) Sabendo que 1 molar de ácido clorídrico, neutraliza 1 molar de hidróxido de sódio, numa titulação ácido-base, foi colocado num erlenmayer 50.0 mL de hidróxido de sódio de concentração 0,2 molar. Quantos mililítros (mL) de ácido clorídrico 1,0 molar, você deverá titular sobre a solução de soda caustica do erlenmeyer para neutraliza-lo?
Responda. Faça o cálculo.
10) 250 mL de hidróxido de sódio (NaOH) 0,01 molar precisa ser neutralizado pelo ácido sulfúrico (H2SO4). Pergunta-se: quantas gramas desse ácido serão necessárias para a neutralização total da base?
Responda. Faça o cálculo.
11) (adaptado) O oxalato de cálcio (CaC2O4) está presente no espinafre, no tomate, pimentão, aspargo, folhas de chá, acelga etc. Aparece nos exames de urina I, especialmente nas urinas ácidas, também é responsável pela formação de cálculo renal. Um estudante trabalhando com 25 cm3 de uma amostra de solução com 0,2625 g de oxalato de cálcio, quer saber a sua concentração comum.
Responda. Faça o cálculo e depois assinale a alternativa correta.
a) 0,0105 gL
b) 0,00656 gL
c) 10,5 gL
d) 21 gL
e) 31,5gL
12) (adaptado da Vunesp) a partir de uma solução de concentração 15 mol/L, prepare 500 mL de solução aquosa de ácido sulfúrico (H2SO4) de concentração 3 mol/L.
Raciocínio lógico.
Responda fazendo o cálculo. Assinale apenas a alternativa correta.
a) 200 mL
b) 300 mL
c) 400 mL
c) 400 mL
d) 100 mL
e) 150 mL
13) (adaptado) Sabe-se que o ácido fosfórico também faz parte da nossa dieta alimentar. Quando ingerido é digerido no estômago e absorvido pelo organismo na forma de fósforo. 1 L de refrigerante coca-cola contém 0.6 g de ácido fosfórico. Sabendo que uma pessoa pode tomar até 5 mg/kg de seu peso corporal, um indivíduo de 42 kg pode tomar quantas latinhas de 350 mL por dia? Assinale a alternativa correta.
Responda fazendo o cálculo.
Bibliografia
Ricardo Feltre, Química, Físico Química. Volume 2, Editora Moderna, 6ª edição São Paulo 2004.
Ricardo Feltre, Química, Físico Química. Volume 2, Editora Moderna, 6ª edição São Paulo 2004.