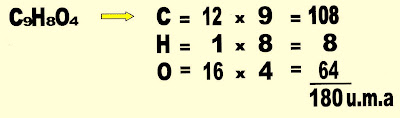Cálculos das Massas
Cálculos Preliminares
Exercícios
1) Calcular a quantidade de carvão gasta para produzir 7,0 milhões de toneladas de cal virgem em quilogramas e em toneladas.
Dados: na produção de 1,0 kg (1000 g) de cal virgem consome-se 0,312 kg de carvão.
Ao iniciar os cálculos devemos primeiramente transformar os valores de toneladas para quilograma.
1) Calcular a quantidade de carvão gasta para produzir 7,0 milhões de toneladas de cal virgem em quilogramas e em toneladas.
Dados: na produção de 1,0 kg (1000 g) de cal virgem consome-se 0,312 kg de carvão.
Ao iniciar os cálculos devemos primeiramente transformar os valores de toneladas para quilograma.
2) Calcular a quantidade de ferro gusa produzido num alto-forno em uma única vez, sendo que o gasto da massa de carvão para a produção desse ferro foi de 3,64 x 104 toneladas.
Dados: 1,0 kg de ferro = 0,910 kg de carvão.
Adaptado do caderno do aluno ciências da natureza e suas tecnologias - química - 1º série, volume 2 p. 7.
3) Sabendo-se que a massa de 10,0 toneladas de calcário (CaCO3) produz a massa de 5,6 toneladas de cal virgem (CaO) e 4,4 toneladas de dióxido de carbono. Ao ser produzido a massa de 11,2 toneladas de cal virgem, quanto de calcário é necessário para obter esse valor e quanto de gás carbônico será liberado na calcinação do calcário?
Adaptado do caderno do aluno ciências da natureza e suas tecnologias - química - 1ª série, volume 2 p.21.
Exercícios
Para o aluno calcular.
Para produzir 1 kg de cal virgem (CaO) necessita-se de 0,312 kg de carvão.
4) De acordo com esse dado, quanto de carvão eu devo gastar para produzir os valores da cal virgem abaixo relacionados?
5) Quanto de carvão eu devo gastar na produção dos seguintes valores de ferro gusa?
106 kg 103 t 500 kg 100 000 000 g
6) Qual a massa de gás carbônico produzido na combustão dos seguintes valores de carvão:
24 kg 25
t 500 g 1000 t
Exercícios
Para o aluno calcular.
Para produzir 1 kg de cal virgem (CaO) necessita-se de 0,312 kg de carvão.
4) De acordo com esse dado, quanto de carvão eu devo gastar para produzir os valores da cal virgem abaixo relacionados?
7 t 700 kg 1 t 7 x 106
t
7 x 102
t 500 kg 106 g 7 x 1012 g
7 x 103
t 0,5 t 109 g 10 kg
Para produzir 1,0 kg de ferro gusa é necessário 0,910 kg de carvão.
105 t 109 kg 600 kg 1 000 000 g
106 t 1012 kg 1800 kg 10 000 000 g
15 t 100 kg 5 kg 12
kg
18 t 1000 kg 1800 g 100 t
A tabela abaixo mostra as massas dos elementos químicos na ordem crescente de seus números atômicos.
H
|
Hidrogênio
|
1,00797
|
1
|
He
|
Hélio
|
4,0026
|
4
|
Li
|
Lítio
|
6,941
|
7
|
Be
|
Berílio
|
9,0122
|
9
|
B
|
Boro
|
10,811
|
11
|
C
|
Carbono
|
12,01115
|
12
|
N
|
Nitrogênio
|
14,0067
|
14
|
O
|
Oxigênio
|
15,9994
|
16
|
F
|
Flúor
|
18,9984
|
19
|
Ne
|
Neônio
|
20,183
|
20
|
Na
|
Sódio
|
22,9898
|
23
|
Mg
|
Magnésio
|
24,312
|
24
|
Al
|
Alumínio
|
26,9815
|
27
|
Si
|
Silício
|
28,086
|
28
|
P
|
Fósforo
|
30,9738
|
31
|
S
|
Enxofre
|
32,064
|
32
|
Cl
|
Cloro
|
35,453
|
35,5
|
Ar
|
Argônio
|
39,948
|
40
|
K
|
Potássio
|
39,098
|
39
|
Ca
|
Cálcio
|
40,08
|
40
|
Sc
|
Escândio
|
44,956
|
45
|
Ti
|
Titânio
|
47,90
|
48
|
V
|
Vanádio
|
50,942
|
51
|
Cr
|
Cromo
|
51,996
|
52
|
Mn
|
Manganês
|
54,9380
|
55
|
Fe
|
Ferro
|
55,847
|
56
|
Co
|
Cobalto
|
58,93
|
59
|
Ni
|
Níquel
|
58,69
|
59
|
Cu
|
Cobre
|
63,55
|
63,5
|
Zn
|
Zinco
|
65,38
|
65
|
Ga
|
Gálio
|
69,72
|
70
|
Ge
|
Germânio
|
72,59
|
73
|
As
|
Arsênio
|
74,9216
|
75
|
Se
|
Selênio
|
78,96
|
79
|
Br
|
Bromo
|
79,90
|
80
|
Kr
|
kriptônio
|
83,80
|
84
|
Rb
|
Rubídio
|
85,47
|
85
|
Sr
|
Estrôncio
|
87,62
|
88
|
Y
|
Ítrio
|
88,91
|
89
|
Zr
|
Zircônio
|
91,22
|
91
|
Nb
|
Nióbio
|
92,91
|
93
|
Mo
|
Molibdênio
|
95,94
|
96
|
Tc
|
Tecnécio
|
98
|
98
|
Ru
|
Rutênio
|
101,1
|
101
|
Rh
|
Ródio
|
102,9
|
103
|
Pd
|
Paládio
|
106,4
|
106
|
Ag
|
Prata
|
107,9
|
108
|
Cd
|
Cádimio
|
112,4
|
112
|
In
|
Índio
|
114,8
|
115
|
Sn
|
Estanho
|
118,7
|
119
|
Sb
|
Antimônio
|
121,7
|
122
|
Te
|
Telúrio
|
127,6
|
128
|
I
|
Iodo
|
126,9
|
127
|
Xe
|
Xenônio
|
131,3
|
131
|
Cs
|
Césio
|
132,9
|
133
|
Ba
|
Bário
|
137,3
|
137
|
La
|
Lantânio
|
138,9
|
139
|
Ce
|
Cério
|
140,1
|
140
|
Pr
|
Preseodímio
|
140,9
|
141
|
Nd
|
Neodímio
|
144,2
|
144
|
Pm
|
Promécio
|
145,
|
145
|
Sm
|
Samário
|
150,4
|
150
|
Eu
|
Európio
|
152,0
|
152
|
Gd
|
Gadolínio
|
157,3
|
157
|
Tb
|
Térbio
|
158,9
|
159
|
Dy
|
Disprósio
|
162,5
|
162
|
Ho
|
Hólmio
|
164,9
|
165
|
Er
|
Érbio
|
167,3
|
167
|
Tm
|
Túlio
|
168,9
|
169
|
Yb
|
Ytérbio
|
173,0
|
173
|
Lu
|
Lutécio
|
175,0
|
175
|
Hf
|
Háfinio
|
178,5
|
178,5
|
Ta
|
Tântalo
|
180,9
|
181
|
W
|
Tungstênio
|
183,8
|
184
|
Re
|
Rênio
|
186,2
|
186
|
Os
|
Ósmio
|
190,2
|
190
|
Ir
|
Irídio
|
192,2
|
192
|
Pt
|
Platina
|
195,1
|
195
|
Au
|
Ouro
|
197,0
|
197
|
Hg
|
Mercúrio
|
200,6
|
200
|
Tl
|
Tálio
|
204,4
|
204
|
Pb
|
Chumbo
|
207,2
|
207
|
Bi
|
Bismuto
|
209,0
|
209
|
Po
|
Polônio
|
209
|
209
|
At
|
Astato
|
210
|
210
|
Rn
|
Radônio
|
222
|
222
|
Fr
|
Frâncio
|
223
|
223
|
Ra
|
Rádio
|
226
|
226
|
Ac
|
Actínio
|
227
|
227
|
Th
|
Tório
|
232
|
232
|
Pa
|
Protactínio
|
231
|
231
|
U
|
Urânio
|
238,0
|
238
|
Np
|
Netúnio
|
237
|
237
|
Pu
|
Plutônio
|
244
|
244
|
Am
|
Amerício
|
243
|
243
|
Cm
|
Cúrio
|
247
|
247
|
Bk
|
Berquélio
|
247
|
247
|
Cf
|
Califórnio
|
251
|
251
|
Es
|
Einstênio
|
252
|
252
|
Fm
|
Férmio
|
257
|
257
|
Md
|
Mendelévio
|
258
|
258
|
No
|
Nobélio
|
259
|
259
|
Lr
|
Laurêncio
|
260
|
260
|
Rf
|
Rutherfórdio
|
261
|
261
|
Db
|
Dúbnio
|
262
|
262
|
Sg
|
Seabórgio
|
263,1
|
263
|
Bh
|
Bóhrio
|
262,1
|
262
|
Hs
|
Hássio
|
265
|
265
|
Mt
|
Meitnério
|
269
|
269
|
Ds
|
Darmstácio
|
269
|
269
|
Rg
|
Roentgênio
|
272
|
272
|
Para efetuarmos cálculos químicos devemos ter primeiramente o conhecimento de unidade de massa atômica (u.m.a.)
.
A Unidade de Massa Atômica
Uma unidade de massa atômica (u.m.a.) corresponde a massa de um próton ou de um nêutron, partícula positiva e neutra presentes no núcleo do átomo.
Podemos também dizer que um u.m.a. corresponde a um doze avos da massa do isótopo de carbono de massa 12 que pode ser representada pela figura abaixo.
O número 0,0833 corresponde ao isótopo de hidrogênio de massa 1.
Entretanto, somando as massas dos três isótopos de hidrogênio, hidrogênio de massa 1, hidrogênio de massa 2 e hidrogênio de massa 3 e dividimos por três, obtemos o valor da massa do isótopo de hidrogênio de massa dois, 0,166 que é a média das massas dos três isótopos. Esse valor será a unidade padrão para as massas dos elementos químicos da tabela periódica.
Exemplos de átomo - grama.
O peso de um átomo é a sua massa dividida pelo número de Avogadro. É dado pela expressão abaixo:
Exercícios
Calcular o número de mol
1) Ao adoçar uma xícara de café o uma pessoa colocou uma colher de açúcar sacarose de 15 g. Quantos mol de açúcar o indivíduo ira tomar?
Adaptado - Química - o homem e a natureza. Geraldo Jose Covre. Ed. FTD, 2000. Vol. 1 p. 384, questão 79 -Fuvest - SP.
Como a massa de próton e do nêutron coincide com a massa do hidrogênio.
Ao valor de 0,166 encontrado anteriormente é acrescentado o número de Avogadro e teremos o peso de um átomo de hidrogênio.
Ao pesquisar os gases ideais, nitrogênio, hidrogênio, o Italiano Avogadro percebeu que esses gases a mesma pressão e temperatura teriam o mesmo número de partículas preenchendo o mesmo espaço. A esse valor ele denominou de número de átomos presentes em um átomo-grama, molécula-grama, ou íons-grama que coincidia ao valor de 6,02 x 1023 partículas.
Átomo – Grama
Elemento químico
|
Massa atômica
|
Átomo - grama
|
Número de partículas
|
H - hidrogênio
|
1 u.m.a.
|
1 g
|
6,02 x 10+23 átomos
|
O - oxigênio
|
16 u.m.a.
|
16 g
|
6,02 x 10+23 átomos
|
S – enxofre
|
32 u.m.a.
|
32 g
|
6,02 x 10+23 átomos
|
Ca - cálcio
|
40 u.m.a.
|
40 g
|
6,02 x 10+23 átomos
|
Fe - ferro
|
56 u.m.a.
|
56 g
|
6,02 x 10+23 átomos
|
Zn - zinco
|
65 u.m.a.
|
65 g
|
6,02 x 10+23 átomos
|
Hg - mercúrio
|
200 u.m.a.
|
200 g
|
6,02 x 10+23 átomos
|
1) Quantos átomos-grama há em 2 gramas do hidrogênio atômico (H)?
4) Quantos átomos-grama há em 8 gramas do oxigênio atômico (O)?
6) Em um átomo-grama de oxigênio (O) que corresponde a massa de 16,0 gramas, há 6,02 x 1023 átomos. Quantos átomos de oxigênio atômico há em:
b) 12,0 g ?
Seguindo os exemplos dos itens a e b o aluno deverá calcular quantos átomos há nos valores das massas do oxigênio apresentadas abaixo:
c) 6,5 g, d) 4,0 g, e) 2,0 g, f) 1,0 g, g) 0,9 g, h) 0,7 g, i) 0,5 g, J) 0, 25 g, k) 0,125 g, l) 1,0 mg, m) 1,0 kg, n) 100,0 g.
Dado: massa do Ca = 40 g
Assinale somente a alternativa correta.
d) O elemento químico cálcio é muito importante para o nosso organismo. A sua utilidade está na atuação como cátion nas células do coração, promovendo a força de contração do músculo cardíaco e mantendo juntamente com outros íons, a estabilidade dos "batimentos cardíacos", participa na formação e manutenção da estrutura óssea do nosso corpo. Na reposição do cálcio do seu corpo, uma pessoa ingere uma cápsula de 500 mg de cálcio diária. Quantos átomos de cálcio essa pessoa estará ingerindo a cada dia?
Dado: massa do Ca = 40 g
Assinale somente a alternativa correta.
a) 0,075 x 1021 átomos de cálcio.
b) 1,75 x 1023 átomos de cálcio.
c) 7,5 x 1021 átomos de cálcio.
d) 0,5 x 1023 átomos de cálcio.
e) 1,5 x 1021 átomos de cálcio.
O Peso de um Átomo
O peso de um átomo é a sua massa dividida pelo número de Avogadro. É dado pela expressão abaixo:
1) Qual é o peso de um átomo de hidrogênio (H) se a sua massa é 1.
2) Qual é o peso de um átomo de carbono (C) cuja massa é 12.
3) Qual é o peso de 6,02 x 10+²³ átomos de carbono (C).
Exercícios de fixação
4) Qual é o peso (massa) de:
a) 1 átomo de sódio (Na)?
b) 2 átomos de sódio (Na)?
c) 3 átomos de sódio (Na)?
O aluno deve continuar os cálculos a seguir.
d) 5 átomos de sódio (Na)? j) 1010 átomos de sódio (Na)
e) 10 átomos de sódio (Na) k) 1015 átomos de sódio (Na)?
f) 102 átomos de sódio (Na)? l) 1020 átomos de sódio (Na)?
g) 103 átomos de sódio (Na)? m) 1023 átomos de sódio (Na)?
h) 104 átomos de sódio (Na)? n) 1025 átomos de sódio (Na)?
i) 106 átomos de sódio (Na)?
o) 1030 átomos de sódio (Na)?
Número de Massa de um Elemento Químico
Achamos a massa de um elemento químico multiplicando as massas de cada um de seus isótopos naturais encontrados na natureza pela sua porcentagem, somando os resultados do valor encontrado para cada um e dividindo pela somatória de suas porcentagens.
Por exemplo: como achar a massa do átomo de cloro?
Atualmente são conhecidos 17 isótopos de cloro, Cl 31; Cl 32; Cl 33; Cl 34; Cl 35; Cl 36; Cl 37; Cl 38; Cl 39; Cl 40; Cl 41; Cl 42; Cl 43; Cl 44; Cl 45; apenas dois isótopos são abundantes na natureza Cl 35 e Cl 37.
Isótopo 1 do cloro de massa 34,969 u.m.a. é encontrado na natureza 75,4%.
Isótopo 2 do cloro de massa 36,966 u.m.a. é encontrado na natureza 24,6%.
Substância
|
Molécula
|
Massa molecular
|
Molécula- grama
|
Número de moléculas
|
Gás hidrogênio
|
H2
|
2 u.m.a.
|
2 g
|
6,02 x 1023
|
Água
|
H2O
|
18 u.m.a.
|
18 g.
|
6,02 x 1023
|
Ácido sulfúrico
|
H2SO4
|
98 u.m.a.
|
98 g.
|
6,02 x 1023
|
Hidróxido de sódio
|
NaOH
|
40 u.m.a.
|
40 g.
|
6,02 x 1023
|
Hidróxido de alumínio
|
Al (OH)3
|
78 u.m.a.
|
78 g.
|
6,02 x 1023
|
Sacarose
|
C12H22O11
|
342 u.m.a.
|
342 g.
|
6,02 x 1023
|
Ácido acetilsalicilico
|
C9H8O4
|
180 u.m.a.
|
180 g.
|
6,02 x 1023
|
Cafeína
|
C6H10N4O2
|
170 u.m.a.
|
170 g.
|
6,02 x 1023
|
O Número de Átomos e Elementos Químicos Presentes em Uma Molécula
A molécula do gás hidrogênio.
É formada por apenas 1 elemento químico, hidrogênio, e possui 2 átomos.
A molécula da água.
É formada por 2 elementos químicos diferentes, o hidrogênio e o oxigênio, no total a molécula possui 3 átomos.
A molécula do ácido sulfúrico
É formada por 3 elementos químicos diferentes, o hidrogênio, enxofre e oxigênio, no total a molécula possui 7 átomos.
A molécula do hidróxido de alumínio.
É formada por 3 elementos químicos diferentes, o alumínio, oxigênio e hidrogênio, no total a molécula possui 7 átomos.
A molécula da aspirina, (ácido acetilsalicílico)
É formada por 3 elementos químicos diferentes, o carbono, hidrogênio e o oxigênio, no total a molécula possui 9 carbonos, 8 hidrogênios, 4 oxigênio, 21 átomos.
Como Calcular a Massa de Uma Molécula
Para calcularmos a massa de uma molécula, basta somarmos os valores das massas de seus elementos químicos.
Calcular a massa da água.
Calcular a massa do ácido sulfúrico.
Calcular a massa do hidróxido de cálcio
Calcular a massa da sacarose da cana-de-açúcar.
Calcular a massa do ácido acetilsalicílico, analgésico e antipirético.
Mol é a massa representativa de um elemento químico, molécula ou de substâncias, sabendo que há nesse valor o número embutido de 6,02 x 1023 partículas.
Calcular a massa da molécula de cafeina, estimulante do café.
Exercícios
Calcular as seguintes massas moleculares e compostos iônicos.
HCl; b) H2S; H3AsO4; HBr; HI; H2SO4; H3PO4; H2CO3; CH3COOH; HClO4; H4P2O7; H2CrO4; NaOH; KOH; LiOH; Al(OH)3; Mg(OH)2; Fe(OH)3; Ca(OH)2; NH4OH; Pb(OH)4;Cu(OH)2; Ba(OH)2; NaCl; NaHCO3; Li2CO3; MgSO4:Na2SO4; NaHPO4; BaSO4; (NH4)2CO3; FeSO4; CaSO4; KNO3; NO; NO2; Cl2O3; SO3; Al2O3; SiO2; C12H22O11; C8H10N4O2; CH3(CH2)16CH3
Dado as massas:
H = 1; Cl = 35,5; S = 32; As = 75; O = 16; Br = 80; I = 127; P = 31; C = 12; Cr = 52; Na = 23; K = 39; Mg = 24; Fe = 56; Ca = 40; N = 14; Pb = 207; Cu = 63,5; Ba = 138; Li = 7; Al = 27; Si = 28
Calculando as massas
HCl = 1 + 35,5 = 36,5 u.m.a.
H2S = (1 x 2) + 32 = 2 + 32 = 34 u.m.a.
H3AsO4 = (1 x 3) + 75 + (4 x16) = 3 + 75 + 64 = 142 u.m.a.
H Br = .........................................................................................................
HI = .............................................................................................................
Mol e Números de Mol
Mol é a massa representativa de um elemento químico, molécula ou de substâncias, sabendo que há nesse valor o número embutido de 6,02 x 1023 partículas.
Substância
|
Átomo
|
Molécula ou composto iônico
|
Massa grama (s)
|
Número de partículas
|
Número de mol
|
Hidrogênio
|
H
|
-
|
1,0
|
6,02 x1023
|
1 mol
|
Oxigênio
|
O
|
-
|
16,0
|
6,02 x1023
|
1 mol
|
Cálcio
|
Ca
|
-
|
40,0
|
6,02 x1023
|
1 mol
|
Ferro
|
Fe
|
-
|
56,0
|
6,02 x1023
|
1 mol
|
Ouro
|
Au
|
-
|
197,0
|
6,02 x1023
|
1 mol
|
Gás hidrogênio
|
-
|
H2
|
2,0
|
6,02 x1023
|
1 mol
|
Água
|
-
|
H2O
|
18,0
|
6,02 x1023
|
1 mol
|
Cloreto de sódio
|
-
|
NaCl
|
58,5
|
6,02 x1023
|
1 mol
|
Eugenol
|
-
|
C10H12O2
|
164,0
|
6,02 x1023
|
1 mol
|
Sacarose
|
-
|
C12H22O11
|
342,0
|
6,02 x1023
|
1 mol
|
Calcular o número de mol
1) Ao adoçar uma xícara de café o uma pessoa colocou uma colher de açúcar sacarose de 15 g. Quantos mol de açúcar o indivíduo ira tomar?
2) Quantos mols há em 2,0 gramas do gás hidrogênio?
5) Considerando que um litro de água pura a 25 ºC e 1 atmosfera de pressão pesa 1,0 kg, calcule quantos mols dessa água há no litro. Dados H = 1; O = 16
1 mililitro (mL) de água = 1,0 grama
6) O medicamento hidróxido de alumínio, usado contra acidez estomacal, coadjuvante no tratamento de úlcera gástrica e duodenal e também esofagite de refluxo, vem numa embalagem que contém 240 mL na forma de suspensão oral na dosagem de 6% de Al(OH)3. Quanto mols da substância ativa há no conteúdo desse frasco? Considerar suspensão = 1,0 g/mL.
7) Um médico receita para um indivíduo adulto, necessitando de suplemento de cálcio o valor correspondente a 4 cápsulas por dia de 500 mg de CaCO3, casca de ostras de pureza 100%. A partir desses dados você é capaz de dizer qual a necessidade diária de cálcio desse paciente e quanto ele ingere por dia?
Dados: Ca = 40u; C = 12 u; O = 16 u.
Como o paciente toma 4 cápsulas por dia:
Adaptado - Química - o homem e a natureza. Geraldo Jose Covre. Ed. FTD, 2000. Vol. 1 p. 384, questão 79 -Fuvest - SP.
Para o Aluno Calcular
7) Sabendo-se que um mol da substância iônica cloreto de sódio (NaCl) corresponde a 58,5 gramas, calcule quantas gramas há em:
0,1 mol 0,4 mol 0,7 mol 0,01 mol 0,07 mol 2,0 mol
0,2 mol 0,5 mol 0,8 mol 0,03 mol 0,09 mol 3,0 mol
0,3 mol 0,6 mol 0,9 mol 0,05 mol 0,095 mol 3,5 mol
8) Um mol de ácido sulfúrico (H2SO4) corresponde a 98 gramas. Quanto(s) mol de ácido sulfúrico haverá em:
196,0 g 490,0 g 49,0 g 6,25 g 0,78 g
294,0 g 588,0 g 24,5 g 3,125 g 0,39 g
392,0 g 600,0 g 12,5 g 1,5625 g 0,195 g
8) Contar o número de átomos e calcular as massas das moléculas do éter comum e do éter vinílico.
éter comum éter vinílico
Contar o número de átomos e calcular a massa da molécula do Eugenol.
Contar o número de átomos e calcular a massa da molécula do ácido acetil salicílico.
Ácido acetil salicílico
Contar o número de átomos e calcular as massas das moléculas da norepinefrina e da clorpromazida.
Norepinefrina clorpromazida
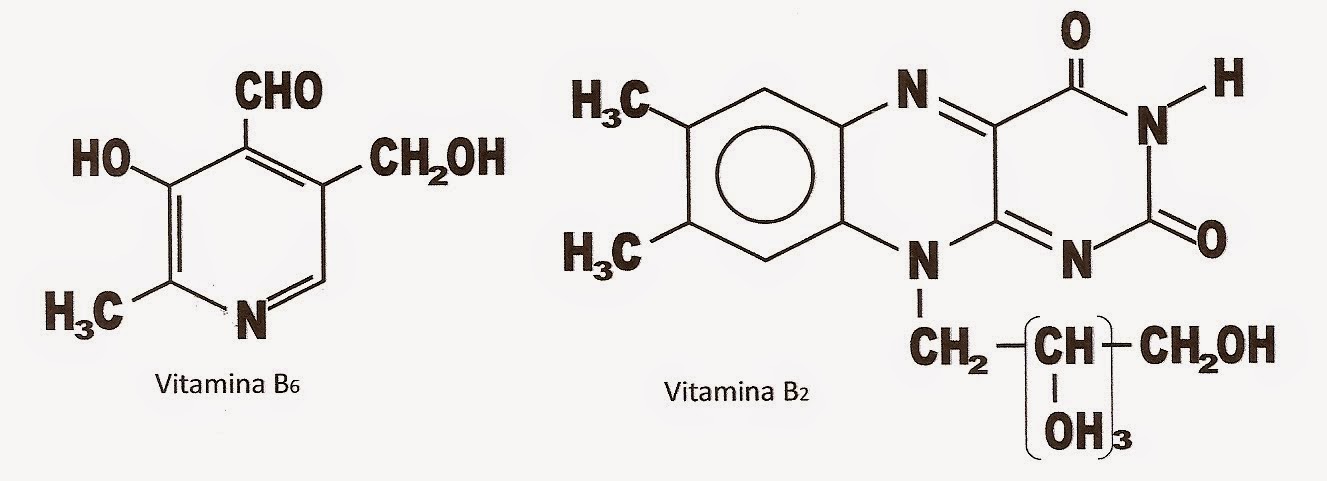
Contar o número de átomos e calcular as massas das moléculas da vitamina B6 e B2.
Vitamina B6 Vitamina B2