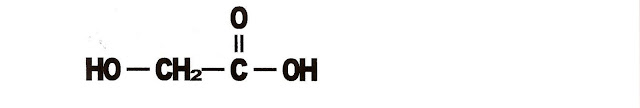
Ácidos Carboxílicos
Definição
Os ácidos carboxílicos podem conferir cheiro ás substâncias, alguns são malcheirosos, outros, conferem odores agradáveis às substâncias que os contêm. Esses ácidos são componentes das gorduras e óleos vegetais e animais.
Propriedades Físicas
Os ácidos carboxílicos abrangem uma quantidade expressiva de compostos, os de cadeias menores, o ácido fórmico e o acético são líquidos incolores. Por possuírem certa polaridade nas moléculas, podem reagir em solução aquosa, portanto são solúveis em água. Outra característica dessas duas substâncias são ter caráter volátil bem irritante, o que podemos conferir, ao inalarmos, por exemplo; aquela utilizada em análise laboratorial, o ácido acético glacial.
Os com 5, até nove carbonos na cadeia carbônica principal, são poucos solúveis em água, e os compostos do grupo de cadeias carbônicas com dez ou mais carbonos possuem consistência de cera sólida branca, não são solúveis em água, mas podem ser solúveis em álcool, éter ou benzeno. Aparecem na natureza nos vegetais e nos animais.
Os com 5, até nove carbonos na cadeia carbônica principal, são poucos solúveis em água, e os compostos do grupo de cadeias carbônicas com dez ou mais carbonos possuem consistência de cera sólida branca, não são solúveis em água, mas podem ser solúveis em álcool, éter ou benzeno. Aparecem na natureza nos vegetais e nos animais.
A Classificação Dos Ácidos Carboxílicos
A Classificação de Acordo Com O número de Carboxila na Molécula.
Ácidos Monocarboxílicos
São substâncias que possuem apenas uma carboxila na extremidade da molécula.
Ácido Metanóico ou Ácido Fórmico
O ácido metanoico possui uma única carboxila, com a estrutura molecular com um único átomo de carbono, dois hidrogênios e dois átomos de oxigênio.
Ácidos Dicarboxílicos.
São substâncias que possuem duas carboxilas na molécula.
Ácido Malônico
Ácido Etanodióico ou Ácido Oxálico
Esse ácido carboxílico aparece nas frutas cítricas como laranja, limão etc. É usado como
antioxidante,
O ácido metanoico possui uma única carboxila, com a estrutura molecular com um único átomo de carbono, dois hidrogênios e dois átomos de oxigênio.
Ácido oxálico
Ácido Tricarboxilico
conservante e acidulante.
Classificação em Ácidos Carboxílicos Alifáticos, Alicíclicos, Aromáticos e Mistos
Exemplo de Ácidos Carboxílicos com Anel Benzênico
Fontes e Origens Dos Ácidos Carboxílicos
A China, entre outros países, é atualmente um grande produtor e exportador desse material,
o ácido fórmico sendo produzido industrialmente em larga escala, que é apresentado na
forma líquida com 85 % de pureza, armazenado em embalagens próprias ou galões de 25, 35,
250 kgs ou até mais, que no transporte devem ser mantidos longe de temperaturas altas pois
é muito inflamável. Deve ser armazenado na sombra, protegido da chuva, em lugares frescos,
secos e ventilados. Tem a sua aplicação na industria do couro e textil, ai tem a aplicabilidade
como agente de tingimento, na industria de pesticidas na produção do triadimefon, na
industria química como formamide ou dimetilformamide, anti oxidante. Na industria médica
na produção de aminoácidos t, cafeina, vitamina B1. na industria da borracha na coagulação
látex.
Classificação em Ácidos Carboxílicos Alicíclicos
Ácidos carboxílicos aliciclicos são aqueles que tem uma cadeia carbônica cíclica na estrutura molecular.
Ácido ciclo pentano-carboxílico
Ácido Carboxílico Com Anel Benzênico
Ácido benzóico
O ácido benzóico possui o anel benzênico na sua estrutura molecular.
Exemplos de Ácidos Carboxílicos
Ácido metanóico ou Ácido fórmico - ácido das formigas
Algumas espécies de formigas possuem esse ácido que é usado como autodefesa, sendo também o responsável pelo cheiro característico da própria formiga, quando ela pica uma pessoa o local fica irritado. Abelhas e espécies de plantas como a urtiga e o pinheiro também sintetizam esse ácido.
Exemplo de Ácidos Carboxílicos com Anel Benzênico
Ácido ftálico ou benzeno dicarboxílico-1,2
Ácido diidróxi-butanóico ou ácido tartárico
Fontes e Origens Dos Ácidos Carboxílicos
Ácido que é produzido industrialmente, possui sabor azedo é encontrado no comércio na forma de cristal
sólido diihidratado C2H2O4. 2 H2O, é pouco solúvel em água, mas bem solúvel em etanol, é
muito venenoso.
O ácido oxálico é fabricado por algumas empresas, uma delas; a
Bramar Chemie da alemanha, ou a GmbH, Xian Litesi Chemical
Co., LTD da China, e ainda a Boss Oil da Alemanha. É sintetizado a partir
do ácido acético (HCOOH) que reage com hidróxido de sódio (NaOH) liberando água. A partir desse ponto, se transforma em metanoato
de sódio (HCOONa+) um composto salino que reage a temperatura de 400 graus
Celsius liberando uma molécula de H2, tendo como o produto final o ácido oxálico (C2H2O4) que é comercializado anidro ou hidratado.
Outras fontes naturais desse ácido são o tomate, a beterraba, inhame, cacau,
carambola, onde é encontrado em grande quantidade e por
isso é altamente tóxica para pessoas com disfunções renais. Em ruibarbo, amendoim, espinafre. No ruibarbo a alta concentração
desse ácido nas suas folhas pode levar intoxicação e a morte de
indivíduos ao ingerir 1500 mg da substância.
Fonte e Origem do Ácido Butanoico
O ácido butanoico é encontrado na manteiga estragada. Esse ácido dá a manteiga deteriorada o cheiro de rançosa.
Ácido Acético
Processos de obtenção
O ácido acético é encontrado na proporção de aproximadamente 7% no vinagre. São vários os processos de obtenção. Na industria é obtido por fermentação bacteriana um dos microrganismos produtores é o Mycoderma aceti, que transforma álcool em ácido acético. Outro processo é o de Monsanto, processo químico de obtenção; outro processo de destilação é o a seco, que consiste em extrair da madeira seca em temperatura controlada o ácido pirolenhosos que contem aproximadamente 10 % de ácido acético, há o processo de Herman Kolbe que consiste em transformar o bissulfeto de carbono em tetracloreto de carbono seguindo-se a reação por pirólise desse composto que se transforma em tetracloroetileno, que por cloração aquosa forma o ácido tricloroacético que submetido á redução eletrolítica forma o ácido acético. Por reação química pode ser produzido pela oxidação do acetaldeido com o auxílio de catalisadores.
O processo de Monsanto para se obter o metanol (CH3OH) é o seguinte: adiciona ácido iodídrico (HI) ao álcool metanol que sofre a retirada da hidroxila por ação do ácido iodídrico, essa hidroxila se junta a oxigênio e sai como água (H2O) é formado o composto CH3I, na continuidade do processo entra o catalisador (RhI) que se junta ao monóxido de carbono. Dois CH3I se juntam com doismonóxido de carbono (CO) formam um composto com 18 carbonos (CO)2RhI2), que sofre reação de descarboxilação e forma um composto com 16 carbonos, com parcial produção do ácido acético. Ao continuar o ciclo, é necessário a adição de mais CO, com nova quantidade de (RhI) adicionado forma-se novamente o composto com 18 carbonos, dessa substância deriva o composto CH3OI que sofre hidratação, saindo o iodo como ácido iodídrico (HI) e finalmente completa-se a reação de produção total do ácido acético.
Ácido hexadecanóico
Está presente no óleo de palma, da qual é extraído.
Ácido ftálico
O ácido ftálico pode ser sintetizado industrialmente a partir do naftaleno, ou mais precisamente da oxidação do tetracloronaftaleno.
Ácido láctico - lático
É produzido por animais e plantas. No ser humano, na musculatura, é derivado da metabolização da glicose que fornece energia para suas atividades. Após exercícios físicos prolongados, se acumula nos locais respectivos, principalmente na musculatura, é o causador de cãimbras e dores musculares. É encontrado no leite coalhado pela transformação da lactose do leite por algumas espécies de bactérias, por exemplo; o Streptococcus lactis, ou bacilus acidophylus. O ácido lático também está sendo testado para ser produzido industrialmente pela fermentação do xarope do pedúnculo do caju (Anacardium orcidentale) com o microrganismo Leuconostoc mesenteroides B512F. Outro modo de obtenção é feito por reação química do etanal com a solução de ácido sulfúrico e cianeto de sódio.
A Utilidade Dos Ácidos Carboxílicos
Ácido fórmico
Ácido etanoico
Ácido propanoico
A Formação do Dexon
Como a Polimerização Acontece
Ácido tereftálico álcool etilenoglicol
O ácido tereftálico se une ao álcool etilenoglicol com a saída de água pela combinação da hidroxila do álcool com a da carboxila.
Francisco Miragaia Peruzzo, eduardo Leite do Canto. Química Na Abordagem do Cotidiano. Química Orgânica. Volume 3, 2ª edição. Editora Moderna, São Paulo 1999.
Presençadeácidooxáliconosalimentos.ácidooxáliconacomida...www.mundoeducacau.com.br>quimica
Ácido oxálico - Wikipédia, a enciclopédia livre pt.wikipedia.org/wiki/ácido_oxálico
Aline Thais Bruni, Ana Luiza Petillo Nery, Paulo A. G. Bianco, Rodrigo Marchiori Liegel, Simone Garcia de Ávila, Simone Jaconetti Ydi, Solange Wagner Locatelli, Vera Lúcia Mitiko Aoki. Ser Protagonista. Química- Ensino Médio, 2ª Edição, Volume 3, 3º Ano. Editora SM, São Paulo - 2013
Ácidos orgânicos - QNEsc qnesc.sbq.org.br/online/qnesc15/v15a)2.pdf
O ácido butanoico é encontrado na manteiga estragada. Esse ácido dá a manteiga deteriorada o cheiro de rançosa.
Ácido Acético
Processos de obtenção
O ácido acético é encontrado na proporção de aproximadamente 7% no vinagre. São vários os processos de obtenção. Na industria é obtido por fermentação bacteriana um dos microrganismos produtores é o Mycoderma aceti, que transforma álcool em ácido acético. Outro processo é o de Monsanto, processo químico de obtenção; outro processo de destilação é o a seco, que consiste em extrair da madeira seca em temperatura controlada o ácido pirolenhosos que contem aproximadamente 10 % de ácido acético, há o processo de Herman Kolbe que consiste em transformar o bissulfeto de carbono em tetracloreto de carbono seguindo-se a reação por pirólise desse composto que se transforma em tetracloroetileno, que por cloração aquosa forma o ácido tricloroacético que submetido á redução eletrolítica forma o ácido acético. Por reação química pode ser produzido pela oxidação do acetaldeido com o auxílio de catalisadores.
O processo de Monsanto para se obter o metanol (CH3OH) é o seguinte: adiciona ácido iodídrico (HI) ao álcool metanol que sofre a retirada da hidroxila por ação do ácido iodídrico, essa hidroxila se junta a oxigênio e sai como água (H2O) é formado o composto CH3I, na continuidade do processo entra o catalisador (RhI) que se junta ao monóxido de carbono. Dois CH3I se juntam com doismonóxido de carbono (CO) formam um composto com 18 carbonos (CO)2RhI2), que sofre reação de descarboxilação e forma um composto com 16 carbonos, com parcial produção do ácido acético. Ao continuar o ciclo, é necessário a adição de mais CO, com nova quantidade de (RhI) adicionado forma-se novamente o composto com 18 carbonos, dessa substância deriva o composto CH3OI que sofre hidratação, saindo o iodo como ácido iodídrico (HI) e finalmente completa-se a reação de produção total do ácido acético.
Ácido hexadecanóico
Está presente no óleo de palma, da qual é extraído.
Ácido ftálico
O ácido ftálico pode ser sintetizado industrialmente a partir do naftaleno, ou mais precisamente da oxidação do tetracloronaftaleno.
Ácido láctico - lático
É produzido por animais e plantas. No ser humano, na musculatura, é derivado da metabolização da glicose que fornece energia para suas atividades. Após exercícios físicos prolongados, se acumula nos locais respectivos, principalmente na musculatura, é o causador de cãimbras e dores musculares. É encontrado no leite coalhado pela transformação da lactose do leite por algumas espécies de bactérias, por exemplo; o Streptococcus lactis, ou bacilus acidophylus. O ácido lático também está sendo testado para ser produzido industrialmente pela fermentação do xarope do pedúnculo do caju (Anacardium orcidentale) com o microrganismo Leuconostoc mesenteroides B512F. Outro modo de obtenção é feito por reação química do etanal com a solução de ácido sulfúrico e cianeto de sódio.
Ácido diidróxi- butanóico ou ácido tartárico
O ácido diidróxi-butanóico ou ácido tartárico é muito solúvel em água, está presente na uva e no vinho, encontra-se também no mosto fermentado, no suco fermentado da polpa de uva, em outros; vagem do tamarindo, abacaxi, amora ou beterraba. No mercado pode ser encontrado industrializado na forma cristalizada em embalagens de 1 kg.
É produzido no intestino do ser humano por microrganismo, um fungo ou seja; uma levedura, industrialmente pode ser produzido pela reação química do ácido maleico com o peróxido de hidrogênio ainda ser obtido pela fermentação de polpas de uva, abacaxi, tamarindo.
Ácido propenóico
Líquido insaturado volátil, de aparência incolor também chamada de acrilato de metila, dilui fracamente em água, dilui bem em álcool e outros solventes orgânicos. Um dos grandes produtores industriais é a China, é vendido em toneladas.
Ácido propenóico
Líquido insaturado volátil, de aparência incolor também chamada de acrilato de metila, dilui fracamente em água, dilui bem em álcool e outros solventes orgânicos. Um dos grandes produtores industriais é a China, é vendido em toneladas.
A Utilidade Dos Ácidos Carboxílicos
Ácido fórmico
Uma das utilidades do ácido fórmico está no emprego na industria médica, na produção do aminoácidos triptofano.
Ácido etanoico
O ácido acético presente no vinagre que é usado como
tempero de saladas e vinagrete, sendo o responsável pelo sabor azedo que
proporciona ao alimento temperado.
Na forma de ácido acético glacial tem
aplicação na produção de essências, perfumes, nesse caso
é utilizado como solvente, é também utilizado na preparação (mordente no tingimento de têxteis) da seda artificial, na produção da aspirina, na detecção laboratorial do vírus do papiloma H.P.V., na produção do plástico acetado de vinila (PVA), de anidrido acético, no diagnóstico colposcópico ou de citologia oncótica do câncer cérvico ou do colo uterino.
Ácido propanoico
Experimentos científicos recentes, tem demonstrado que o ácido propiônico ou propanoico juntamente com o butírico e acético, pode ser utilizado para o crescimento de animais bovinos e ovinos. Segundo os pesquisadores esse ácido é capaz de promover o aumento da massa muscular nesses animais por ser capaz de reter hidrogênio no organismo.
Ácido oxálico
Tem aplicação no tingimento de tecidos nos processos de alvejamento, no cortume do couro, na purificação de óleos e gorduras para clarear, na limpeza de metais, na galvanoplastia por limpar metais, no processo fermentativo de penicilinas e antibióticos semi-sintéticos
Ácido ftálico
É empregado na produção de corantes, resinas sintéticas, na produção de polímeros poliéster,
ou de fibras de terylene, tergal, trevira. O ácido ftálico na medicina é utilizado como lacto purga ou seja; laxante. Também é utilizado para a produção de fenolftaleina um indicador ácido base.
Ácido lático
O ácido lático produzido por microrganismos por exemplo: o Lactobacilus casei. Está contido nos yogurtes cuja produção industrial tem grande destaque na economia.
Ácidos graxos secretados por glândulas localizadas na pele ou no tecido cutâneo humano é utilizado por bactérias por exemplo, do gênero estaphylococcus e micrococcus para obtenção de energia e sobrevivência. Nesse caso esses microrganismos ao metabolizar essas substâncias liberam como um dos resíduos o ácido lático.
Ácido propenoico
É aplicado na fabricação de resinas acrílicas e polímeros de acrílico que forma plástico, na industria têxtil, como surfactante na produção de adesivos, etc.
Ácido Valérico
É um líquido oleoso retirado da (raiz) da Angélica archangelica planta utilizada como agente digestivo contra gases e do rizoma ou raiz da Valeriana officinalis, planta perene com flor que é utilizada como sedativo, provoca sono e é hipnótico e também pode ser usado como agente no tratamento da acne. Da valeriana se obtém o ácido valérico que é utilizado para transtornos do fígado, doenças do trato digestivo e urinário, nas náuseas e na insônia, é empregado em casos de histeria, nervosismo e epilepsia.
A Nomenclatura Dos Ácidos Carboxílicos
Ácido lático
O ácido lático produzido por microrganismos por exemplo: o Lactobacilus casei. Está contido nos yogurtes cuja produção industrial tem grande destaque na economia.
Ácidos graxos secretados por glândulas localizadas na pele ou no tecido cutâneo humano é utilizado por bactérias por exemplo, do gênero estaphylococcus e micrococcus para obtenção de energia e sobrevivência. Nesse caso esses microrganismos ao metabolizar essas substâncias liberam como um dos resíduos o ácido lático.
Ácido propenoico
É aplicado na fabricação de resinas acrílicas e polímeros de acrílico que forma plástico, na industria têxtil, como surfactante na produção de adesivos, etc.
Ácido Valérico
É um líquido oleoso retirado da (raiz) da Angélica archangelica planta utilizada como agente digestivo contra gases e do rizoma ou raiz da Valeriana officinalis, planta perene com flor que é utilizada como sedativo, provoca sono e é hipnótico e também pode ser usado como agente no tratamento da acne. Da valeriana se obtém o ácido valérico que é utilizado para transtornos do fígado, doenças do trato digestivo e urinário, nas náuseas e na insônia, é empregado em casos de histeria, nervosismo e epilepsia.
A Nomenclatura Dos Ácidos Carboxílicos
O carbono da cadeia em que está situada a carboxila é o número um, o carbono seguinte ao da carboxila é o carbono alfa (α), o seguinte é o beta (β) e o posterior é o gama (γ).
A Numeração Dos Carbonos na Cadeia
A ordem de numeração dos carbonos da cadeia principal é feita a partir do carbono da carboxila (COOH) como se observa no seguinte exemplo
Exemplos
A ordem de numeração dos carbonos da cadeia principal é feita a partir do carbono da carboxila (COOH) como se observa no seguinte exemplo
Seguindo-se a regra geral, igualmente a dos outros grupos funcionais da química orgânica para a nomenclatura, dependendo do número de carbonos da cadeia coloca-se o prefixo met, et, prop, but, pent, assim por diante:
Se a cadeia carbônica tiver somente carbonos ligados por um único traço entre os carbonos a palavra monossilaba a seguir ao prefixo será "an", se tiver apenas uma dupla ligação na cadeia será "en" e se tiver três traços numa das ligações entre os carbonos será "in" e finalmente coloca-se a terminação "óico"Exemplos
Ácido metanóico
Ácido
etanóico
Ácido propanoico
Ácido hexadecanóico
Nomenclatura Para Ácidos Carboxílicos Insaturados
Nomenclatura de Ácidos Carboxílicos Com Anel Benzênico
Ácido benzeno carboxílico (IUPAC)
Outros nomes
Ácido benzóico
Ácido carboxibenzeno
Ácido E210, dracílico
Outros nomes
Ácido benzóico
Ácido carboxibenzeno
Ácido E210, dracílico
Nomenclatura de Ácidos Carboxílicos Mistos
Ácido carboxílico que apresenta na sua estrutura um radical funcional dos álcoois.
Ácido carboxílico que apresenta na sua estrutura um radical funcional dos álcoois.
Isomeria Que Acontece Com os Ácidos Carboxílicos
Isomeria de Cadeia
Isomeria Óptica
Ácido propanoico e ácido propanoico
Ácido propanoico espelho Ácido propanoico
Ácido lático espelho ácido lático
Os mesmos isômeros do ácido lático com ácido lático.
Ácido lático espelho ácido lático
Isomeria de posição
Nós diferenciamos uma abelha rainha de uma abelha operária visualmente, porém em Appis mellifera, o ácido-9-hidroxidec-2-enoico é produzido pelas glândulas mandibulares da rainha das abelhas, enquanto que o ácido-10-hidroxidec-2-enoico é produzido pelas abelhas operárias. Esses feromônios são os sinalizadores químicos responsáveis pelo reconhecimento entre as abelhas da rainha e dos operários.
Observe a diferença na estrutura das moléculas dos dois feromônios, o que os tornam isômeros um do outro. Esses isômeros são chamados de isômeros de posição.
Ácido propanoico espelho Ácido propanoico
Ácido lático espelho ácido lático
Os mesmos isômeros do ácido lático com ácido lático.
Ácido lático espelho ácido lático
Isomeria de posição
Nós diferenciamos uma abelha rainha de uma abelha operária visualmente, porém em Appis mellifera, o ácido-9-hidroxidec-2-enoico é produzido pelas glândulas mandibulares da rainha das abelhas, enquanto que o ácido-10-hidroxidec-2-enoico é produzido pelas abelhas operárias. Esses feromônios são os sinalizadores químicos responsáveis pelo reconhecimento entre as abelhas da rainha e dos operários.
Observe a diferença na estrutura das moléculas dos dois feromônios, o que os tornam isômeros um do outro. Esses isômeros são chamados de isômeros de posição.
Polímeros Dos Ácidos Carboxílicos
A Polimerização Para Formar o Poliéster, Dacron, ou Terilene
A Formação do Dexon
Como a Polimerização Acontece
Ácido tereftálico álcool etilenoglicol
O ácido tereftálico se une ao álcool etilenoglicol com a saída de água pela combinação da hidroxila do álcool com a da carboxila.
sai água sai água sai água sai água
O polímero de dracon fica:
Outro Tipo de Polimerização
A Formação do Dexon a Partir do Ácido Glicólico
A Estrutura do Ácido Glicólico
Ácido glicólico
A reação se dá entre as moléculas do ácido glicólico que vão se juntando e reagindo; o OH das carboxilas reage com o radical álcool da molécula e sai como água. Esse monômero formado vão se juntando para formar o polímero do Dexon, outro tipo de poliéster.
Os monômeros formados se repetem inúmeras vezes formando o polímero.
Polímero do Dacron outro tipo de poliéster
Reações Que Acontecem Com os Ácidos Carboxílicos
Reação de Oxidação Dos Ácidos Carboxílicos
A Formação de um Ácido Carboxílicos a Partir de um
Álcool
O álcool se junta ao oxigênio atômico que retira um hidrogênio do seu radical funcional, na sequência a reação retira outro hidrogênio do álcool e sai como água, forma assim um aldeído que na sequência reage com outro oxigênio atômico.
O álcool se junta ao oxigênio atômico que retira um hidrogênio do seu radical funcional, na sequência a reação retira outro hidrogênio do álcool e sai como água, forma assim um aldeído que na sequência reage com outro oxigênio atômico.
Que entra para formar a carboxila, resultando na estrutura a seguir.
O radical R pode ser representado pelo grupo metil, resultando na estrutura apresentada acima, o ácido carboxílico.
Reação de Preparação do Ácido Acético a Partir do Álcool Etílico
Reação de Oxidação
O álcool etílico reage com o oxigênio do ar liberando uma molécula de água e formando assim o ácido acético. Observe a reação.
O álcool etílico reage com o oxigênio do ar liberando uma molécula de água e formando assim o ácido acético. Observe a reação.
A mesma reação de preparação do ácido acético.
Exercícios
1) Os ácidos carboxílicos são muito importantes no nosso dia a dia, sua presença na natureza se comprova de várias formas e o ser humano produz industrialmente uma variedade grande desses compostos para o seu uso próprio. podemos definir os ácidos carboxílicos como compostos orgânicos:
a) de caráter ácido forte, que possuem na sua estrutura molecular um ou mais radical funcional, Hidroxila (OH), que na estrutura molecular, aparece sempre ligada ao carbono primário, da (s) extremidade (s) da cadeia carbônica.
b) de caráter ácido fraco, que possuem na sua estrutura molecular um ou mais radical funcional, a carbonila (COH), que na estrutura molecular, aparece sempre ligada ao carbono secundário, da cadeia carbônica.
c) de caráter básico forte, que possuem na sua estrutura molecular um radical funcional, a carboxila (COOH), que na estrutura molecular, aparece sempre ligada ao carbono primário, da (s) extremidade (s) da cadeia carbônica.
d) de caráter salino forte, que possuem na sua estrutura molecular um ou mais radical funcional, a carboxila (COOH), aparece sempre ligada ao carbono primário, geralmente da (s) extremidade (s) da cadeia carbônica.
e) de caráter ácido fraco, que possuem na sua estrutura molecular um ou mais radical funcional, carboxila (COOH), que aparece sempre ligada ao carbono primário, geralmente da (s) extremidade (s) da cadeia carbônica.
Bibliografia1) Os ácidos carboxílicos são muito importantes no nosso dia a dia, sua presença na natureza se comprova de várias formas e o ser humano produz industrialmente uma variedade grande desses compostos para o seu uso próprio. podemos definir os ácidos carboxílicos como compostos orgânicos:
a) de caráter ácido forte, que possuem na sua estrutura molecular um ou mais radical funcional, Hidroxila (OH), que na estrutura molecular, aparece sempre ligada ao carbono primário, da (s) extremidade (s) da cadeia carbônica.
b) de caráter ácido fraco, que possuem na sua estrutura molecular um ou mais radical funcional, a carbonila (COH), que na estrutura molecular, aparece sempre ligada ao carbono secundário, da cadeia carbônica.
c) de caráter básico forte, que possuem na sua estrutura molecular um radical funcional, a carboxila (COOH), que na estrutura molecular, aparece sempre ligada ao carbono primário, da (s) extremidade (s) da cadeia carbônica.
d) de caráter salino forte, que possuem na sua estrutura molecular um ou mais radical funcional, a carboxila (COOH), aparece sempre ligada ao carbono primário, geralmente da (s) extremidade (s) da cadeia carbônica.
e) de caráter ácido fraco, que possuem na sua estrutura molecular um ou mais radical funcional, carboxila (COOH), que aparece sempre ligada ao carbono primário, geralmente da (s) extremidade (s) da cadeia carbônica.
2) Enem 2018 Prova Amarela questão
101. As abelhas usam a sinalização química
para distinguir a abelha rainha de uma operária, sendo capazes de reconhecer
diferenças entre moléculas. A rainha produz o sinalizador químico conhecido
como ácido 9-hidroxidec-2-enoico, enquanto as abelhas operárias produzem ácido
10-hidroxidec-2-enoico. Nós podemos distinguir as abelhas operárias e rainhas
pela sua aparência, mas, entre si, elas usam essa sinalização química para
perceber a diferença. Pode-se dizer que veem por meio da química.
As moléculas dos sinalizadores químicos
produzidas pelas abelhas rainha e operárias possuem diferenças na:
a) fórmula estrutural.
b) fórmula molecular.
c) identificação dos tipos de ligação.
d) contagem dos números de carbonos.
e) identificação dos grupos funcionais.
3) Um ácido carboxílico que é muito solúvel em água, está presente na uva e no vinho, encontra-se também no mosto fermentado, no suco fermentado da polpa de uva, em outros como; vagem, tamarindo, abacaxi, amora ou beterraba. No mercado pode ser encontrado industrializado na forma cristalizada em embalagens de 1 kg é o ácido:
a) 2-propenóico.
b) ftálico.
c) diidróxi- butanóico ou ácido tartárico.
d) 9-hidroxidec-2-enóico.
e) hexadecanóico ou ácido palmítico.
4) O ácido carboxílico que é produzido por animais e plantas e no ser humano, na musculatura, é derivado da metabolização da glicose que fornece energia para suas atividades. Após exercícios físicos prolongados, se acumula nos locais respectivos, principalmente na musculatura, é o causador de cãimbras e dores musculares. É encontrado no leite coalhado pela transformação da lactose do leite por algumas espécies de bactérias, por exemplo; o Streptococcus lactis, ou bacilus acidophylus. Também está sendo testado para ser produzido industrialmente pela fermentação do xarope do pedúnculo do caju (Anacardium orcidentale) com o microrganismo Leuconostoc mesenteroides B512F. Outro modo de obtenção é feito por reação química do etanal com a solução de ácido sulfúrico e cianeto de sódio. Esse ácido carboxílico é o:
a) benzóico.
b) hidroxi-butanóico.
c) 10-hidroxidec-2-enóico.
d) láctico ou lático.
e) ftálico.
5) Quanto a classificação dos ácidos, podemos dizer que os ácidos representados abaixo são respectivamente:
3) Um ácido carboxílico que é muito solúvel em água, está presente na uva e no vinho, encontra-se também no mosto fermentado, no suco fermentado da polpa de uva, em outros como; vagem, tamarindo, abacaxi, amora ou beterraba. No mercado pode ser encontrado industrializado na forma cristalizada em embalagens de 1 kg é o ácido:
a) 2-propenóico.
b) ftálico.
c) diidróxi- butanóico ou ácido tartárico.
d) 9-hidroxidec-2-enóico.
e) hexadecanóico ou ácido palmítico.
4) O ácido carboxílico que é produzido por animais e plantas e no ser humano, na musculatura, é derivado da metabolização da glicose que fornece energia para suas atividades. Após exercícios físicos prolongados, se acumula nos locais respectivos, principalmente na musculatura, é o causador de cãimbras e dores musculares. É encontrado no leite coalhado pela transformação da lactose do leite por algumas espécies de bactérias, por exemplo; o Streptococcus lactis, ou bacilus acidophylus. Também está sendo testado para ser produzido industrialmente pela fermentação do xarope do pedúnculo do caju (Anacardium orcidentale) com o microrganismo Leuconostoc mesenteroides B512F. Outro modo de obtenção é feito por reação química do etanal com a solução de ácido sulfúrico e cianeto de sódio. Esse ácido carboxílico é o:
a) benzóico.
b) hidroxi-butanóico.
c) 10-hidroxidec-2-enóico.
d) láctico ou lático.
e) ftálico.
5) Quanto a classificação dos ácidos, podemos dizer que os ácidos representados abaixo são respectivamente:
a) monocarboxílico, dicarboxílicos e
alifáticos.
b) monocarboxílicos, dicarboxílicos e
mistos.
c) monocarboxílicos, dicarboxílicos e tricarboxílicos.
d) tricarboxílicos,
alifáticos, mistos e aromáticos.
e) aromáticos, mistos, dicarboxílicos e tricarboxílicos.
Francisco Miragaia Peruzzo, eduardo Leite do Canto. Química Na Abordagem do Cotidiano. Química Orgânica. Volume 3, 2ª edição. Editora Moderna, São Paulo 1999.
Presençadeácidooxáliconosalimentos.ácidooxáliconacomida...www.mundoeducacau.com.br>quimica
Ácido oxálico - Wikipédia, a enciclopédia livre pt.wikipedia.org/wiki/ácido_oxálico
Aline Thais Bruni, Ana Luiza Petillo Nery, Paulo A. G. Bianco, Rodrigo Marchiori Liegel, Simone Garcia de Ávila, Simone Jaconetti Ydi, Solange Wagner Locatelli, Vera Lúcia Mitiko Aoki. Ser Protagonista. Química- Ensino Médio, 2ª Edição, Volume 3, 3º Ano. Editora SM, São Paulo - 2013
Ácidos orgânicos - QNEsc qnesc.sbq.org.br/online/qnesc15/v15a)2.pdf
Ricardo Feltre. Química, Química Orgânica. Volume 3, Editora Moderna. 6ª edição, São Paulo 2004.
Problemas de levedura Great Plains Laboratory www.greatplainslaboratory.com/portuguese/ yeast.html
Martha Reis Marques da Fonseca- Química, Ensino Médio- Meio Ambiente Cidadania Tecnologia. Volume 3. Editora FTD, 1ª Edição, São Paulo 2010.
Geraldo Jose Covre. Química - O Homem e a Natureza, Química Orgânica, Volume 3. Editora FTD, São Paulo, 2000.
Ácido lático - Quimica - InfoEscola www.infoescola. com > Quimica
Ácido acético - Wikipédia - Wikipedia pt.wikipedia.org/wikiÁcido_etanoic
Magno Urbano de Macedo & Antonio Carvalho. Química - Atende aos Parâmetros do Ensino Médio, IBEP Instituto Brasileiro de Edições Pedagógicas.
Acrylic acid (2-propenoic acid) - Chemical Land21 chemicalland21.com/.../acrylic%20acid.htm
tese edmilson - Locus UFV
www.locus.ufv.br/bitstream/handle/123456789/244/texto%completo.pdf. ...1...y
Martha Reis Marques da Fonseca- Química, Ensino Médio- Meio Ambiente Cidadania Tecnologia. Volume 3. Editora FTD, 1ª Edição, São Paulo 2010.
Geraldo Jose Covre. Química - O Homem e a Natureza, Química Orgânica, Volume 3. Editora FTD, São Paulo, 2000.
Ácido lático - Quimica - InfoEscola www.infoescola. com > Quimica
Ácido acético - Wikipédia - Wikipedia pt.wikipedia.org/wikiÁcido_etanoic
Magno Urbano de Macedo & Antonio Carvalho. Química - Atende aos Parâmetros do Ensino Médio, IBEP Instituto Brasileiro de Edições Pedagógicas.
The utilization of acetic, propionic and butiric acids by growing heifers journal.cambridge.org/article_s0007114563000441
Acrylic acid (2-propenoic acid) - Chemical Land21 chemicalland21.com/.../acrylic%20acid.htm
tese edmilson - Locus UFV
www.locus.ufv.br/bitstream/handle/123456789/244/texto%completo.pdf. ...1...y
tese edmilson - Locus UFV
Usberco Salvador & Edgard Salvador. Química - Volume Único 5ª Edição, Editora Saraiva. São Paulo 2002.
www.locus.ufv.br/bitstream/handle/123456789/244/texto%20completo.pdf?...1...y
Texto em construção.