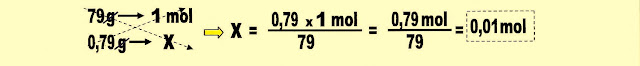Recordando - Um Pouco de Potenciação
100
|
Um
|
1
|
101
|
Dez
|
10
|
102
|
Cem
|
100
|
103
|
Mil
|
1000
|
104
|
Dez mil
|
10 000
|
105
|
Cem mil
|
100 000
|
106
|
Um milhão
|
1000 000
|
107
|
Dez milhões
|
10 000 000
|
108
|
Cem milhões
|
100 000 000
|
109
|
Um bilhão
|
1000 000 000
|
1010
|
Dez bilhões
|
10 000 000 000
|
1011
|
Cem bilhões
|
100 000 000 000
|
1012
|
Um trilhão
|
1000 000 000 000
|
1013
|
Dez trilhões
|
10 000 000 000 000
|
1014
|
Cem trilhões
|
100 000 000 000 000
|
1015
|
Um quadrilhão
|
1000 000 000 000 000
|
1016
|
Dez quadrilhões
|
10 000 000 000 000 000
|
1017
|
Cem quadrilhões
|
100 000 000 000 000 000
|
1018
|
Um quintilhão
|
1000 000 000 000 000 000
|
1019
|
Dez quintilhões
|
10 000 000 000 000 000 000
|
1020
|
Cem quintilhões
|
100 000 000 000 000 000 000
|
1021
|
Um sextilhão
|
1000 000 000 000 000 000 000
|
1022
|
Dez sextilhões
|
10 000 000 000 000 000 000 000
|
1023
|
Cem sextilhões
|
100 000 000 000 000 000 000 000
|
1024
|
Um septilhão
|
1000 000 000 000 000 000 000 000
|
1025
|
Dez septilhões
|
10 000 000 000 000 000 000 000 000
|
1026
|
Cem septilhões
|
100 000 000 000 000
000 000 000 000
|
1027
|
Um octilhão
|
1000 000 000 000 000
000 000 000 000
|
1028
|
Dez octilhões
|
10 000 000 000 000 000
000 000 000 000
|
1029
|
Cem octilhões
|
100 000 000 000 000 000
000 000 000 000
|
1030
|
Um nonilhão
|
1000 000 000 000 000 000
000 000 000 000
|
1031
|
Dez nonilhões
|
10 000 000 000 000 000 000
000 000 000 000
|
1032
|
Cem nonilhões
|
100 000 000 000 000 000 000
000 000 000 000
|
1033
|
Um decilhão
|
1000 000 000 000 000 000 000 000 000 000 000
|
Medidas Para Comprimento (com expoentes negativos)
m
|
Metro
|
100
|
1 m
|
dc
|
Decímetro
|
10-1
|
0,1 m
|
cm
|
Centímetro
|
10-2
|
0,01 m
|
mm
|
Milímetro
|
10-3
|
0,001 m
|
100 µm
|
Cem micrômetros
|
10-4
|
0,0001 m
|
10 µm
|
Dez micrômetros
|
10-5
|
0,00001 m
|
1 µm
|
Um micrômetro
|
10-6
|
0,000001 m
|
100 nm
|
Cem nanômetros
|
10-7
|
0,0000001 m
|
10 nm
|
Dez nanômetros
|
10-8
|
0, 00000001 m
|
1 nm
|
Um nanômetro
|
10-9
|
0,000000001 m
|
100 pm
|
Cem picômetros
|
10-10
|
0,0000000001 m
|
10 pm
|
Dez picômetros
|
10-11
|
0,00000000001 m
|
1 pm
|
Um picometro
|
10-12
|
0,000000000001 m
|
100 fm
|
Cem fentômetros
|
10-13
|
0,0000000000001 m
|
10 fm
|
Dez fentômetros
|
10-14
|
0,00000000000001 m
|
1 fm
|
Um fentômetro
|
10-15
|
0,000000000000001 m
|
100 am
|
Cem attometros
|
10-16
|
0,0000000000000001 m
|
10 am
|
Dez attometros
|
10-17
|
0,00000000000000001 m
|
1 am
|
Um attometro
|
10-18
|
0,000000000000000001 m
|
100 zm
|
Cem zeptômetros
|
10-19
|
0,0000000000000000001 m
|
10 zm
|
Dez zeptômetros
|
10-20
|
0,00000000000000000001 m
|
1 zm
|
Um zeptômetro
|
10-21
|
0,000000000000000000001 m
|
100 ym
|
Cem yoctômetros
|
10-22
|
0,0000000000000000000001 m
|
10 ym
|
Dez yoctômetros
|
10-23
|
0,00000000000000000000001 m
|
1 ym
|
Um yoctômetro
|
10-24
|
0,000000000000000000000001 m
|
Elemento
Químico
|
Símbolo
|
Massa
|
Massa em
gramas (g)
|
Mol
|
Número de partículas
|
Hidrogênio
|
H
|
1 u.m.a.
|
1
|
1 mol
|
6,02 x 1023 partículas
|
Gás hélio
|
He
|
4 u.m.a.
|
4
|
1 mol
|
6,02 x 1023 partículas
|
Lítio
|
Li
|
7 u.m.a.
|
7
|
1 mol
|
6,02 x 1023 partículas
|
Berílio
|
Be
|
9 u.m.a.
|
9
|
1 mol
|
6,02 x 1023 partículas
|
Boro
|
B
|
10 u.m.a.
|
10
|
1 mol
|
6,02 x 1023 partículas
|
Carbono
|
C
|
12 u.m.a.
|
12
|
1 mol
|
6,02 x 1023 partículas
|
Cálcio
|
Ca
|
40 u.m.a.
|
40
|
1 mol
|
6,02 x 1023 partículas
|
Titânio
|
Ti
|
48 u.m.a.
|
48
|
1 mol
|
6,02 x 1023 partículas
|
Ferro
|
Fe
|
56 u.m.a.
|
56
|
1 mol
|
6,02 x 1023 partículas
|
Platina
|
Pt
|
195 u.m.a.
|
195
|
1 mol
|
6,02 x 1023 partículas
|
Ouro
|
Au
|
197 u.m.a.
|
197
|
1 mol
|
6,02 x 1023 partículas
|
Mercúrio
|
Hg
|
200,5 u.m.a.
|
200,5
|
1 mol
|
6,02 x 1023 partículas
|
Chumbo
|
Pb
|
208 u.m.a.
|
208
|
1 mol
|
6,02 x 1023 partículas
|
Urânio
|
U
|
238 u.m.a.
|
238
|
1 mol
|
6,02 x 1023 partículas
|
Moléculas
|
Símbolo
|
Massa
|
Massa em gramas
|
Mol
|
Número de partículas
|
Água
|
H2O
|
18,0 u.m.a.
|
18,0 g
|
1 mol
|
6,02 x 1023 moléculas
|
Gás hidrogênio
|
H2
|
2,0 u.m.a.
|
2,0 g
|
1 mol
|
6,02 x 1023 moléculas
|
Gás oxigênio
|
O2
|
32,0 u.m.a.
|
32,0 g
|
1 mol
|
6,02 x 1023 moléculas
|
Gás Ozônio
|
O3
|
48,0 u.m.a.
|
48,0 g
|
1 mol
|
6,02 x 1023 moléculas
|
Gás carbônico
|
CO2
|
44,0 u.m.a.
|
44,0 g
|
1 mol
|
6,02 x 1023 moléculas
|
Gás metano
|
CH4
|
16,0 u.m.a.
|
16,0 g
|
1 mol
|
6,02 x 1023 moléculas
|
Ácido clorídrico
|
HCl
|
36,5 u.m.a.
|
36,5 g
|
1 mol
|
6,02 x 1023 moléculas
|
Ácido sulfúrico
|
H2SO4
|
98,0 u.m.a.
|
98,0 g
|
1 mol
|
6,02 x 1023 moléculas
|
Sacarose
|
C6H12O6
|
342,0 u.m.a
|
342,0 g
|
1 mol
|
6,02 x 1023 moléculas
|
Vitamina C
|
C6H8O6
|
176,0 u.m.a
|
176,0 g
|
1 mol
|
6,02 x 1023 moléculas
|
"Exercícios Para Memorização"
a)
|
10 g
|
10 000 mg
|
10 000 000 μg
|
b)
|
1 g
|
1 000 mg
|
1 000 000 μg
|
c)
|
0,1 g
|
100 mg
|
100 000 μg
|
d)
|
0,01 g
|
10 mg
|
10 000 μg
|
e)
|
0,001 g
|
1 mg
|
1000 μg
|
f)
|
0,0001 g
|
0,1 mg
|
100 μg
|
g)
|
0,000 01 g
|
0,01 mg
|
10 μg
|
h)
|
0,000 001 g
|
0,001 mg
|
1 μg
|
4) Transforme as seguintes valores de microgramas para grama
a)
|
100 μg
|
0,0001 g
|
1 x 10-4
g
|
b)
|
200 μg
|
0,0002 g
|
2 x 10-4
g
|
c)
|
300 μg
|
0,0003 g
|
|
d)
|
400 μg
|
||
e)
|
500
μg
|
||
f)
|
600
μg
|
||
g)
|
700
μg
|
||
h)
|
800
μg
|
||
i)
|
900
μg
|
||
j)
|
1000
μg
|
||
k)
|
10 000
μg
|
||
l)
|
100 000 μg
|
||
m)
|
1000 000 μg
|
Calcule as massas de:
A reação balanceada é:
A massa de hidróxido de lítio necessária para a total transformação do gás carbônico é:
Exercícios
Assinale apenas a alternativa correta.
1) Um mol de átomos de carbono corresponde a:
a) 24 u.m.a que
corresponde a 6,02 x1023 partículas,
que pesam 24 gramas, que corresponde a um mol.
b) 12 u.m.a que
corresponde a 6,02 x1023 partículas,
que pesam 12 gramas, que corresponde a um mol.
c) 15 u.m.a que
corresponde a 6,02 x1023 partículas,
que pesam 15 gramas, que corresponde a um mol.
d) 6 u.m.a que corresponde a 6,02 x1023 partículas, que pesam 6 gramas, que corresponde a um mol.
2) Um mol de átomos de ferro corresponde a:
a) 24 u.m.a que
corresponde a 6,02 x1023 partículas,
que pesam 24 gramas, que corresponde a um mol.
b) 35 u.m.a que
corresponde a 6,02 x1023 partículas,
que pesam 35 gramas, que corresponde a um mol.
c) 56 u.m.a que
corresponde a 6,02 x1023 partículas,
que pesam 56 gramas, que corresponde a um mol.
d) 46 u.m.a que corresponde a 6,02 x1023 partículas, que pesam 46 gramas, que corresponde a um mol.
3) Um mol de moléculas de água corresponde a:
a) 18 u.m.a que
corresponde a 6,02 x1023 partículas,
que pesam 24 gramas, que corresponde a um mol.
b) 18 u.m.a que
corresponde a 6,02 x1023 partículas,
que pesam 18 gramas, que corresponde a um mol.
c) 16 u.m.a que
corresponde a 6,02 x1023 partículas,
que pesam 16 gramas, que corresponde a um mol.
d) 28 u.m.a que
corresponde a 6,02 x1023 partículas,
que pesam 28 gramas, que corresponde a um mol.