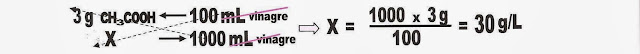Definição
Molaridade é a concentração do mol de uma substância que é a sua massa em gramas em um litro de solução.
O que é um mol de uma substância?
É a massa em gramas dessa substância.
É a massa em gramas dessa substância.
O que é uma substância.
Substância é uma espécie de matéria formada por átomos específicos dessa mesma matéria ; por exemplo, o gás oxigênio é uma substância formada por átomos de oxigênio. As substâncias simples puras são formadas por um único tipo de elemento químico. As substâncias compostas puras são formadas por mais de um tipo de elemento químico componente da molécula.
Uma substância pode aparecer pura. Vejamos exemplos.
Substâncias a nível atômico.
São substâncias formadas por átomos.
Cálcio (Ca) é uma substância pura.
Sódio (Na) é uma substância pura.
Iodo (I) é uma substância pura.
Ferro (Fe) é uma substância pura.
Cobre (Cu) é uma substância pura.
Alumínio (Al) é uma substância pura.
Potássio (K) é uma substância pura.
Ouro (Au ) é uma substância pura.
Substâncias a nível molecular
São substâncias formadas por moléculas.
Gás oxigênio (O2) é uma substância pura simples.
Gás hidrogênio (H2) é uma substância pura simples.
Gás nitrogênio (N2) é uma substância pura simples.
Gás cloro (Cl2) é uma substância pura simples.
Gás ozônio (O3) é uma substância pura simples.
Substâncias compostas puras
Entenda-se aqui, que a substância no estado puro não pode ser misturada com nenhuma outra nem mesmo com água.
Água (H2O) é uma substância pura composta.
Acido clorídrico (HCl) é uma substância pura composta.
Glicose (C6H12O6) é uma substância pura composta.
Sacarose (C12H22O11)e uma substância pura composta.
Ácido acetilsalicílico (C9H8O4) é uma substância pura composta.
Paracetamol (C8H9NO2) é uma substância pura composta.
O diabinese ou clorpropamida (C10H13NO3Cl) é uma substância pura composta.
As massas das Substâncias.
As massas das Substâncias.
As massas das substâncias a nível atômico.
Cálcio (Ca) 40 u = 40 g = 1 mol.
Sódio (Na) 23 u = 23 g = 1 mol.
Iodo (I) 127 u = 127 g = 1 mol.
Ferro (Fe) 56 u = 56 g = 1 mol.
Cobre (Cu) 63,5 u = 63 g = 1 mol.
Alumínio (Al) 27 u = 27 g = 1 mol.
Potássio (K) 39 u = 39 g = 1 mol.
Ouro (Au ) 197 u = 197 g = 1 mol.
As massas das substâncias simples a nível molecular
Gás oxigênio (O2) 32 u = 32 g = 1 mol.
Gás hidrogênio (H2) 2 u = 2 g = 1 mol.
Gás nitrogênio (N2) 28 u = 28 g = 1 mol.
Gás cloro (Cl2) 71 u = 71 g = 1 mol.
Gás ozônio (O3) 48 u = 48 g = 1 mol.
Massas molecular das substâncias compostas
Água (H2O) 18 u = 18,0 g = 1mol.
Acido clorídrico (HCl) 36,5 u = 36,5 g = 1 mol.
Glicose (C6H12O6) 180 u = 180,0 g = 1 mol.
Sacarose (C12H22O11) 342 u = 342,0 g = 1 mol.
Ácido acetilsalicílico (C9H8O4). 96 + 8 + 64 = 168 u = 168 g = 1 mol.
Paracetamol (C8H9NO2). 96 + 9 + 32 = 137 u =137 g = 1 mol.
O diabinese ou clorpropamida (C10H13ClN2O3S).= 276,5 u = 276,5 g = 1 mol
A molaridade dessas substâncias está correlacionada com as suas massas, quando diluídas em um litro de solução.
Transformando Mol em Molaridade
Cálcio (Ca) 40 u = 40 g = 1 mol em 1 L de solução = 1 molar.
Sódio (Na) 23 u = 23 g = 1 mol em 1 L de solução = 1 molar.
Iodo (I) 127 u = 127 g = 1 mol em 1 L de solução = 1 molar.
Ferro (Fe) 56 u = 56 g = 1 mol em 1 L de solução = 1 molar.
Gás oxigênio (O2) 32 u = 32 g = 1 mol em 1 L de solução = 1 molar.
Gás hidrogênio (H2) 2 u = 2 g = 1 mol em 1 L de solução = 1 molar.
Gás nitrogênio (N2) 28 u = 28 g = 1 mol em 1 L de solução = 1 molar.
Gás cloro (Cl2) 71 u = 71 g = 1 mol em 1 L de solução = 1 molar.
Água (H2O) 18 u = 18,0 g = 1mol em 1 L de solução = 1 molar.
Acido clorídrico (HCl) 36,5 u = 36,5 g = 1 mol em 1 L de solução = 1 molar.
Glicose (C6H12O6) 180 u = 180,0 g = 1 mol em 1 L de solução = 1 molar.
Sacarose (C12H22O11) 342 u = 342,0 g = 1 mol em 1 L de solução = 1 molar.
Preparando Soluções
A molaridade dessas substâncias está correlacionada com as suas massas, quando diluídas em um litro de solução.
Transformando Mol em Molaridade
Cálcio (Ca) 40 u = 40 g = 1 mol em 1 L de solução = 1 molar.
Sódio (Na) 23 u = 23 g = 1 mol em 1 L de solução = 1 molar.
Iodo (I) 127 u = 127 g = 1 mol em 1 L de solução = 1 molar.
Ferro (Fe) 56 u = 56 g = 1 mol em 1 L de solução = 1 molar.
Gás oxigênio (O2) 32 u = 32 g = 1 mol em 1 L de solução = 1 molar.
Gás hidrogênio (H2) 2 u = 2 g = 1 mol em 1 L de solução = 1 molar.
Gás nitrogênio (N2) 28 u = 28 g = 1 mol em 1 L de solução = 1 molar.
Gás cloro (Cl2) 71 u = 71 g = 1 mol em 1 L de solução = 1 molar.
Água (H2O) 18 u = 18,0 g = 1mol em 1 L de solução = 1 molar.
Acido clorídrico (HCl) 36,5 u = 36,5 g = 1 mol em 1 L de solução = 1 molar.
Glicose (C6H12O6) 180 u = 180,0 g = 1 mol em 1 L de solução = 1 molar.
Sacarose (C12H22O11) 342 u = 342,0 g = 1 mol em 1 L de solução = 1 molar.
Preparando Soluções
Preparar um litro de solução de cloreto de sódio 1 molar.
Colocar 58,5 gramas de cloreto de sódio puro (P.A.) num recipiente.
Completar para 1000 mL com água destilada ou deionizada, misturar bem.
1) Adaptado. Ao preparar uma solução de hidróxido de sódio (NaOH) puro o técnico de laboratório adicionou 20, 0 gramas da substância para um litro de solução? Qual a molaridade dessa solução?
Dados: Na = 23; O = 16; H = 1 23 + 1 + 16 = 40
M = ? M = molaridade.
m1 = 20,0 g m1 = massa dada na questão.
V = 1 L V = volume para um litro de solução.
M1 = 40,0 g M1 massa de 1 mol do soluto.
Utilizando a seguinte expressão:
Conhecendo a equação para determinar a molaridade podemos resolver esse exercício facilmente.
2) Baseado na questão anterior resolva os seguintes exercícios.
Utilize a equação:
a) Qual a molaridade se fosse colocado 1.0 g de NaOH em 1 L de solução?.
b) Qual a molaridade se fosse colocado 5.0 g de NaOH em 1 L de solução?.
c) Qual a molaridade se fosse colocado 10.0 g de NaOH em 1 L de solução?.
d) Qual a molaridade se fosse colocado 15,5 g de NaOH em 1 L de solução?.
e) Qual a molaridade se fosse colocado 20.0 g de NaOH em 1 L de solução?.
f) Qual a molaridade se fosse colocado 25.0 g de NaOH em 1 L de solução?.
g) Qual a molaridade se fosse colocado 50.0 g de NaOH em 1 L de solução?.
h) Qual a molaridade se fosse colocado 75,5. g de NaOH em 1 L de solução?.
i) Qual a molaridade se fosse colocado 80.0 g de NaOH em 1 L de solução?.
j) Qual a molaridade se fosse colocado 100.0 g de NaOH em 1 L de solução?.
Você pode calcular a molaridade da solução, calculando o número de mol dessa solução pela expressão:
Você pode calcular a molaridade da solução, calculando o número de mol dessa solução pela expressão:
m1 = massa
M1 = número de 1 mol
n1 = número de mol da solução
3) O hidróxido de potássio (KOH) é uma base forte muito utilizada nos laboratórios de química para neutralizar ácidos. Pergunta-se: qual é o número de mol de uma solução de KOH em que foi adicionado 14 gramas da substância em um litro de solução?
Resolução. Utilize a equação:
Resolução. Utilize a equação:
4) Preparar um litro de solução 1 molar das seguintes substâncias
Substância
|
Massa
|
Massa do soluto e do solvente
|
Volume
|
Molaridade
|
HCl
|
36,5 g
|
36,5 g HCl + 963,5 mL H2O
|
1 L solução
|
1 molar
|
H2SO4
|
98,0 g
|
98,0 g H2SO4 + 902,0 mL H2O
|
1 L solução
|
1 molar
|
C6H12O6
|
180,0 g
|
180 g C6H12O6 + 820,0 mL H2O
|
1 L solução
|
1 molar
|
C12H22O11
|
342,0 g
|
342 g C12H22O11 + 652,0 mL H2O
|
1 L solução
|
1 molar
|
NaCl
|
58,5 g
|
58,5 g NaCl + 941,5 mL H2O
|
1 L solução
|
1 molar
|
C16H18ClN3S .3 H2O
|
360,0 g
|
360 g C16H18ClN3S . 3 H2O + 640,0 mL H2O
|
1 L solução
|
1 molar
|
KCl
|
74,5 g
|
74,5g KCl + 925,5 mL H2O
|
1 L solução
|
1 molar
|
NaOH
|
40,0 g
|
40,0g NaOH + 960,0 mL H2O
|
1 L solução
|
1 molar
|
Ca(OH)2
|
74,0 g
|
74,0 g Ca(OH)2 + 926,0 mL H2O
|
1 L solução
|
1 molar
|
KI
|
166,0 g
|
166,0 g KI + 834,0 mL H2O
|
1 L solução
|
1 molar
|
CaCl2
|
111,0 g
|
111,0 g CaCl2 + 889,0 mL H2O
|
1 L solução
|
1 molar
|
Ca
|
40,0 g
|
40,0 g Ca + 940,0 mL H2O
|
1 L solução
|
1 molar
|
C2H5OH
|
46,0 g
|
46,0 g C2H5OH + 954,0 mL H20
|
1 L solução
|
1 molar
|
HCl
|
146,0 g
|
146,0 g HCl + 854,0 mL H2O
|
1 L solução
|
3 molar
|
CH3COONa.3 H2O
|
136,0 g
|
136,0 g CH3COONa . 3 H2O + 864,0 mL H2O
|
1 L solução
|
1 molar
|
5) Adaptado. O sódio é o principal íon extracelular do líquido intersticial, do plasma sanguíneo etc. O córtex da adrenal pela ação do hormônio DOCA, aldosterona e cortisol promove a reabsorção do sódio pelos túbulos renais quando necessário. Por outro lado sua excreção também é regulado pelos rins e excretado na urina. Numa análise laboratorial a análise do sangue de um paciente revelou a concentração do sódio de 145 milimols na forma de Na+para cada decilitro de sangue humano. Pergunta-se: qual a massa em grama de íon sódio presente nos 7 litros estimado de sangue desse paciente?
Resolução
1 mol de Na+ = 23 g/L 1 milimol = 0,001 mol
Primeiramente transformar mol em milimol.
1 mol de Na+ = 23 g/L 1 milimol = 0,001 mol
Sabendo quantas gramas há em 1 mol por litro, calcular quantas gramas há em 1 milimol.
Como foi calculado a massa de Na+ por litro, calcular a massa para decilitro.
Como já havia sido calculado a massa de Na+ para um milimol, calcular para 145 milimol.
Tendo os dados da massa do Na+ em 145 milimols para um decilitro, calcular para 1 litro.
 |
| Sabendo o valor de Na+ para um litro de sangue, calcular para 7 litros de sangue. |
6) Conforme a revista saúde onde há o relato sobre pesquisas da Universidade do Estado da Pensilvânia, nos Estados Unidos de que o leite faz bem ao coração. Conforme estudos da Faculdade de Saúde Pública da Universidade de São Paulo o consumo de leite promove a diminuição da hipertensão... Sabendo que aproximadamente 250 gramas de leite contém 300 mg de Cálcio. Pesquisas também revelaram que para beneficiar uma pessoa, esta deve ingerir diariamente a quantidade 4 vezes desse volume de leite. Conhecendo a quantidade de leite ingerido, calcule o número de mol do cálcio ingerido que coincide com a molaridade do cálcio presente no leite.
Dados:
A densidade média do leite integral é praticamente a da água 1,032 mg/mL (desprezar).
Ca = 40 u = 40 g
Calculamos a molaridade pela regra de três:
Posso também calcular a mesma molaridade pela expressão:
7) O vinagre é utilizado na alimentação, no tempero de saladas. O principal componente que confere a característica ao vinagre é o ácido acético (CH3COOH). Sabendo disso calcule a molaridade do ácido acético do vinagre cuja concentração é de 3%.
Dados : C = 12; H = 1; O = 16.
Conhecendo a massa do ácido acético e a porcentagem no vinagre, já dá para iniciar o cálculo.
3% = 3g de CH3COOH em 100 mL ou 100g de vinagre.
Quanto terei em um litro de vinagre?
Como a massa do CH3COOH é 60g, eu preciso de 60g de CH3COOH por litro para ter o vinagre 1 molar. A massa do ácido acético é de apenas 30g então:
O ácido acético está presente no vinagre na concentração de 0,5 molar.