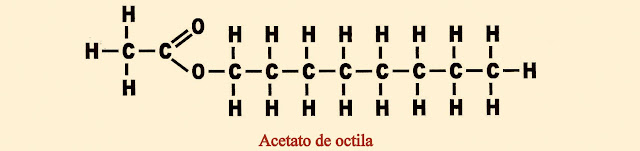
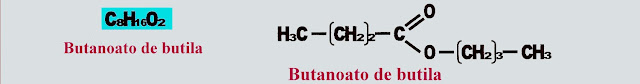
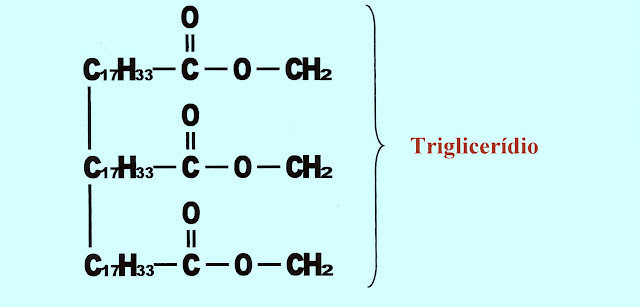
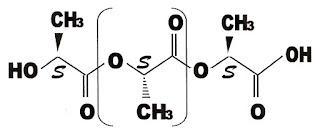
Berílio - Be
O berílio é o quarto elemento químico da tabela periódica, na sequência dos números atômicos. É um metal que apresenta-se no estado sólido.
As Combinações Que o Berílio Forma
As Combinações Que o Berílio Forma
Be4O(O2CCH3)6 (acetato Básico de berílio)
Be4Si2O7(OH)2 (bertrandite)
BeBr2 (brometo de Berílio)
BeCO3 (carbonato de Berílio)
BeCl2 (cloreto de berílio)
BeF2 (fluoreto de berílio)
Be(OH)2 (hidróxido de berílio)
BeI2 (iodeto de berílio)
Be(NO3)2 (nitrato de berílio)
Be3N2 (nitreto de berílio)
BeO (óxido de berílio) (berília)
Berilo (silicato de alumínio e berílio) 3BeO·Al2O3·6SiO2
BeSO4 (sulfato de berílio)
Be2SiO4 (fenaquita)
BeAl2O4 (crisoberilo)
O descobridor do elemento químico berílo foi o Francês Louis Nicolas Vauquelin
- no ano de 1798, estudando dois minerais o berilo e a esmeralda que o continham.
Família
O Berílio pertence a família 2A ou 2, ou família dos metais alcalinos terrosos da tabela periódica.
Isótopos Naturais
O berílio possui somente um isótopo natural. Outros isótopos desse elemento químico não possuem dados de quantidade.
A Massa e Peso de um Único Átomo
A massa atômica do berílio é 9,01 u que corresponde ao seu peso multiplicado pelo número de Avogadro, ou ainda a soma dos prótons e nêutrons do seu núcleo. O peso de um único átomo de berílio é de 1,49 x 10-23 g.
O Número Atômico
O número atômico do berílio é o número de prótons, partícula de carga positiva do seu núcleo que corresponde a 4.
O Número de Nêutrons
O número de nêutrons do berílio é o número de partículas neutras do seu núcleo que corresponde a 5.
Número de Elétrons e Distribuição Eletrônica
O berílio possui 4 elétrons que giram em orbitais circulares, são distribuídos em um único subnível nos dois orbitais "s". 1s2, 2s2..
O Íon Berílio
O berílio ionizado produz o cátion bivalente Be++.
Ponto de fusão e Ebulição
O ponto de fusão do berílio é bem alto de 1287 ºC e o de ebulição é muito alto de aproximadamente 3000 ºC.
Toxicidade
O berílio forma facilmente sais que se inspirados são altamente tóxicos. Essa toxicidade do berílio pode ser aguda e causar sintomas como tosse dolorida, febre e calafrios e acúmulo de fluido nos pulmões.
Obtenção
No Brasil o berílo é um dos minerais mais importantes para a obtenção industrial do berílio. Outra parte do berílio pode ser encontrado em rochas pegmatíticas que contém o (BeO) que no Brasil não é explorado. No entanto estima-se que as reservas de berílio no nosso País seja de apenas 6000 toneladas.
Calcula-se que os E.U.A possui 65 % das jazidas mundiais de berílio, o que torna esse País o produtor mais importante do mundo, com a estimativa de reserva 52000 toneladas de minerais como o berilo a bertrandita, além do berílio encontrado nas rochas pegmatíticas que contém o berílio na forma de BeO de interesse comercial.
Empresas Que Atualmente Atuam no Processamento de Berílio
Empresa Belmont Ltda, situado no município de Itabira Minas Gerais - Brasil. O Brasil exporta o berílio na forma de esmeralda.
Utilização
Por ser um metal leve, é utilizado para fabricar giroscópios e guias inerciais de aparelhos como por exemplo, mísseis e foguetes. Este instrumento mantém a estabilidade do veículo, que pode desenvolver alta velocidade mesmo em lugares de pouca visibilidade.
Na metalurgia o berílio é empregado fabricação de ligas de cobre-berílio.
Outro emprego do berílio está na participação da estrutura de reatores nucleares, aí tem a função de moderador da reatividade dos nêutrons.
É também empregado como refletores de nêutrons. Esse refletor de nêutron pode ser um invólucro com funções bem características que mantém o espaço mínimo para o material nuclear armazenado sem reagir por fissão. Atua impedindo que esse mesmo material se expanda facilmente entrando em reação nuclear. Paralelamente outra função é a de impedir que parte dessas partículas vazem de sua massa concentrada antes de desenvolver uma reação em cadeia.
O berílio também é usado no fabrico de ferramentas que não produzem faíscas quando sofrem atrito.
Bibliografia
Berílio
http://sistemas.dnpm.gov.br/publicaçao/mostra_imagem.asp?...5456
Berílio - DNPM
https://sistemas.dnpm.gov.br/publicacao/mostra_imagem.asp?...6359
Ponto de fusão e Ebulição
O ponto de fusão do berílio é bem alto de 1287 ºC e o de ebulição é muito alto de aproximadamente 3000 ºC.
Toxicidade
O berílio forma facilmente sais que se inspirados são altamente tóxicos. Essa toxicidade do berílio pode ser aguda e causar sintomas como tosse dolorida, febre e calafrios e acúmulo de fluido nos pulmões.
Obtenção
No Brasil o berílo é um dos minerais mais importantes para a obtenção industrial do berílio. Outra parte do berílio pode ser encontrado em rochas pegmatíticas que contém o (BeO) que no Brasil não é explorado. No entanto estima-se que as reservas de berílio no nosso País seja de apenas 6000 toneladas.
Calcula-se que os E.U.A possui 65 % das jazidas mundiais de berílio, o que torna esse País o produtor mais importante do mundo, com a estimativa de reserva 52000 toneladas de minerais como o berilo a bertrandita, além do berílio encontrado nas rochas pegmatíticas que contém o berílio na forma de BeO de interesse comercial.
Empresas Que Atualmente Atuam no Processamento de Berílio
Empresa Belmont Ltda, situado no município de Itabira Minas Gerais - Brasil. O Brasil exporta o berílio na forma de esmeralda.
Utilização
Por ser um metal leve, é utilizado para fabricar giroscópios e guias inerciais de aparelhos como por exemplo, mísseis e foguetes. Este instrumento mantém a estabilidade do veículo, que pode desenvolver alta velocidade mesmo em lugares de pouca visibilidade.
Na metalurgia o berílio é empregado fabricação de ligas de cobre-berílio.
Outro emprego do berílio está na participação da estrutura de reatores nucleares, aí tem a função de moderador da reatividade dos nêutrons.
É também empregado como refletores de nêutrons. Esse refletor de nêutron pode ser um invólucro com funções bem características que mantém o espaço mínimo para o material nuclear armazenado sem reagir por fissão. Atua impedindo que esse mesmo material se expanda facilmente entrando em reação nuclear. Paralelamente outra função é a de impedir que parte dessas partículas vazem de sua massa concentrada antes de desenvolver uma reação em cadeia.
O berílio também é usado no fabrico de ferramentas que não produzem faíscas quando sofrem atrito.
Bibliografia
Berílio
http://sistemas.dnpm.gov.br/publicaçao/mostra_imagem.asp?...5456
Berílio - DNPM
https://sistemas.dnpm.gov.br/publicacao/mostra_imagem.asp?...6359