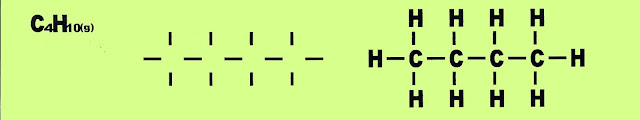Termoquímica
Os tipos de energia utilizada nas ligações é o Joule (J), quilojoule (KJ), caloria (cal) ou quilocaloria (Kcal).
Devemos lembrar que 1 caloria corresponde a 4,18 joules.
O valor da energia nas ligações, absorvida (endotérmica) ou liberada (exotérmica) é medida por cada mol da substância.
Devemos lembrar que um mol de qualquer substância, envolve o número de partículas de 6,02 x 1023 partículas da substância.
Deve-se também levar em conta a pressão e a temperatura padrão de cada reação. A pressão deve ser de 1 atmosfera e a temperatura de 25ºC.
Energia Térmica Nas Ligações Químicas
Energia de Ligação
É a energia absorvida pelas substâncias no estado gasoso, quando um mol das ligações entre seus átomos componentes se rompem.
Exemplos de Ligações Entre os Átomos de Uma Molécula.
Gás Hidrogênio
Uma ligação covalente molecular une os dois átomos de hidrogênio, para formar o gás hidrogênio.
Uma ligação covalente molecular une os dois átomos de hidrogênio, para formar o gás hidrogênio.
Gás hidrogênio A ligação covalente molecular
Água
Duas ligações covalentes moleculares simples, unem dois átomos de hidrogênio ao oxigênio para formar a água.
Água Ligações covalentes moleculares
Água oxigenada
Três ligações covalentes moleculares simples unem dois átomos de hidrogênios com dois átomos de oxigênio para formar a água oxigenada.
Água oxigenada ligações covalentes moleculares
Gá metano
Quatro ligações covalentes moleculares simples, unem 4 hidrogênios ao carbono central para formar o gás metano.
Gás metano ligações covalentes moleculares
Gás Etano
Seis ligações covalentes moleculares simples, unem 6 hidrogênio a dois carbonos ligados entre si por uma única ligação simples para formar o gás etano.
Gás etano ligações covalentes moleculares
Gás butano
Dez ligações carbono - hidrogênio e três ligações carbono - carbono formam a estrutura do gás butano, (gás engarrafado de cozinha).
Gás butano 10 ligações C---H e 3 ligações C---C
Álcool etílico
Cinco ligações carbono - hidrogênio, uma carbono - oxigênio, uma oxigênio - hidrogênio, formam a estrutura molecular do álcool etílico.
5 ligações C---H, 1 ligação C---O, 1 ligação O---H
Energia Das Ligações
Energia de formação das moléculas
Os dois hidrogênios que formam esse gás, possui energia de ligação de 437 kJ/mol.
Gás Etano
Seis ligações covalentes moleculares simples, unem 6 hidrogênio a dois carbonos ligados entre si por uma única ligação simples para formar o gás etano.
Gás butano
Dez ligações carbono - hidrogênio e três ligações carbono - carbono formam a estrutura do gás butano, (gás engarrafado de cozinha).
Gás butano 10 ligações C---H e 3 ligações C---C
Álcool etílico
Cinco ligações carbono - hidrogênio, uma carbono - oxigênio, uma oxigênio - hidrogênio, formam a estrutura molecular do álcool etílico.
5 ligações C---H, 1 ligação C---O, 1 ligação O---H
Energia Das Ligações
Energia de formação das moléculas
Os dois hidrogênios que formam esse gás, possui energia de ligação de 437 kJ/mol.
Duas ligações hidrogênio - oxigênio de 461 kJ cada, formam a molécula de água.
Energia das Combustões
Nas transformações químicas são quebrados e formados novos materiais, nesse rearranjo da matéria; ligações entre átomos são rompidas e outras são formadas, com absorção ou liberação de energia térmica. Cada ligação química tem um valor térmico conhecido específico. Esses valores podem ser representados numa tabela.
Tabela dos Valores das Ligações Químicas
Exercícios
15) O gás metano tem origem nos vulcões, na decomposição de lixo orgânico, ou dos vegetais, folhas, troncos em apodrecimento, é produzido no intestino de animais herbívoros, e até nós humanos produzimos no nosso intestino, por meio de bactérias do tipo Escherichia coli, há traços desse gás presente na atmosfera terrestre, que com o seu aumento causa o efeito estufa, está contido no gás natural, ou no biogás, ou pode se obter juntamente com o petróleo. Atualmente está sendo utilizado como gás canalizado de cozinha e combustíveis para veículos automotores.
17) Qual o total da energia envolvida nas ligações rompidas, dos reagentes metano e do gás oxigênio?
18) Qual o total da energia envolvida, liberada; nas ligações formadas dos produtos da combustão do gás metano (CH4)?
19) Qual a energia liberada, ou o saldo de energia fornecida na combustão de um mol de gás metano?
A chama que sai da boca do fogão e aquece a panela, é o saldo da energia 814 kj/ mol, da combustão do gás metano (CH4).
20) O gás propano, C3H8, é um dos componentes do GLP, gás liquefeito de petróleo. Escolha abaixo a equação correta que representa a combustão desse gás e assinale.
a) 1 C3H8 + 3 O2 ---combustãoà 3 CO2 + 2 H2O
b) 2 C3H8 + 5 O2 ---combustãoà 2 CO2 + 5 H2O
c) 1 C3H8 + 5 O2 ---combustãoà 3 CO2 + 4 H2O
d) 1 C3H8 + 4 O2 ---combustãoà 2 CO2 + 4 H2O
e) 2 C3H8 + 3 O2 ---combustãoà 3 CO2 + 4 H2O